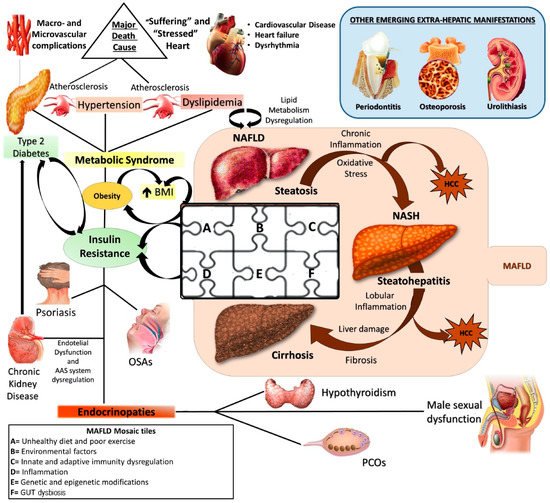
A doença hepática gordurosa não alcoólica (DHGNA) representa um dos distúrbios metabólicos mais importantes do século 21 e a principal causa de doença hepática crônica e transplante de fígado em todo o mundo. A abordagem moderna considera a DHGNA como uma doença metabólica sistêmica, caracterizada por diversas manifestações fora do fígado, principalmente ligadas à resistência ao hormônio insulina.
A abordagem moderna considera a esteatose hepática não alcoólica como uma doença metabólica sistêmica (Dallio et al., 2021)
A prevalência mundial de DHGNA varia entre 6% a 35%, com níveis mais elevados nos países industrializados. Existe uma susceptibilidade genética maior para a doença em indivíduos com polimorfismos de nucleotídeo único (SNPs), em genes como PNPLA3 (rs738409), TM6SF2 (rs58542926) e MBOAT7. (rs641738). Ao mesmo tempo fatores ambientais, como vida sedentária, dietas pouco saudáveis que promovem a resistência à insulina (RI) e disbiose intestinal, juntamente com alguns distúrbios imunológicos (como psoríase) aumentam o risco de desenvolvimento da doença, assim como apneia do sono e doença renal crônica.
Até o momento, não existem medicamentos específicos para o tratamento da DHGNA. Portanto, a modificação do estilo de vida continua sendo a recomendação mais importante e baseia-se em cinco eixos: exercício físico regular, perda de peso, prevenção e tratamento da resistência insulínica, modulação intestinal com tratamento da disbiose intestinal e dieta saudável antiinflamatória.
Uma dieta caracterizada pelo consumo abundante de alimentos de origem vegetal e peixes parece contribuir significativamente para a redução da ocorrência de várias doenças crônicas, incluindo da DHGNA. Esses princípios constituem o paradigma da conhecida dieta mediterrânea, rica em componentes antioxidantes e antiinflamatórios.
Descobertas recentes mostram a capacidade da nutrição e dos componentes da dieta em modificar a expressão de nossos genes. É o que estuda a nutrigenética (que genes são esses) e a nutrigenômica (como fazê-los funcionar melhor).
Nutrigenética e nutrigenômica: duas faces da mesma moeda
O genoma influencia a capacidade de resposta aos nutrientes (campo da nutrigenética). Ao mesmo tempo, a nutrição também pode modificar a expressão gênica envolvendo mecanismos epigenéticos (campo da nutrigenômica).
Pessoas com polimorfismo (SNP) no rs738409 do gene PNPLA3 (ou Adiponutrina), devem ser acompanhados. A enzima codificada pelo gene pNPLA4 tem atividade na lipase de triglicerídeos, estando envolvida na sua utilização como fonte de energia e no seu armazenamento. A presença do alelo G deste SNP está associado a aumento dos níveis de triglicerídeos nas vesículas dos hepatócitos (células do fígado). Isto é ainda mais recorrente se o paciente tiver resistência à insulina e/ou obesidade.
O gene PNPLA3 também está envolvido na liberação da forma de armazenamento do retinol (vitamina A), conhecida como retinil-palmitato, nas células estreladas hepáticas. Devido ao envolvimento do retinil-palmitato na regulação do metabolismo da gordura celular, sua retenção em pessoas com este SNP gera maior respostas pró-inflamatórias e pró-fibrótica.
Assim, é importante maior consumo de peixes e ômega-3 neste pacientes, redução do consumo de ultraprocessados e carboidratos simples, assim como retirada do álcool da dieta. Atividade física e controle das calorias consumidas também é importante.
O gene MBOAT7 codifica uma enzima ligada à membrana e cuja função principal é a incorporação de ácido araquidônico (AA) e outros ácidos graxos insaturados na molécula de fosfatidilinositol. Na presença da variante rs641738, a expressão da enzima codificada diminui junto com os níveis hepáticos de PI contendo AA, o que causa uma interrupção de várias vias celulares que regulam o metabolismo de triglicerídeos, inflamação, fibrose e proliferação celular. Aqui a conduta é reduzir o consumo de gorduras saturadas e gorduras do tipo ômega-6.
O gene TM6SF2 é responsável pela produção de uma proteína localizada principalmente no retículo endoplasmático e aparelho de Golgi, envolvida na regulação da secreção hepática de triglicerídeos. A codificação rs58542926 C> T para a variante E167K desse gene está envolvida no desenvolvimento de esteatose hepática n ão alcoólica. Por outro lado, esse SNP parece conferir proteção contra o risco de doença cardiovascular por meio da redução da secreção de lipídios e da síntese de lipoproteínas de densidade muito baixa (VLDL), desenhando um papel biológico muito complexo que ainda precisa ser totalmente esclarecido. Mesmo assim, parece que para estes pacientes a redução da ingestão de carboidratos seja importante.
Além dos SNPs PNPLA3, MBOAT7 e TM6SF2, outras variantes genéticas aparecem potencialmente envolvidas neste cenário. Existem fortes evidências científicas para que o polimorfismo do gene regulador de glucoquinase (GCKR) aumenta a resistência insulínica. Assim, pessoas com a presença do alelo C para o rs780094 também precisarão envitar carboidratos simples.
Como se sabe, a superprodução de espécies reativas de oxigênio (ROS) derivada de sobrecarga de ácidos graxos livres (FFAs) na mitocôndria e devido à resistência insulínica também piora a esteatase. Pacientes com polimorfismos para as enzimas SOD precisarão de dietas ricas em antioxidantes e suplementação condizente com o caso.
O uso de chás e ervas também é interessante evitando a oxidação de moléculas como o colesterol e mantendo um quadro menos inflamatório, propício à recuperação hepática. À luz do conhecimento científico recente, a dieta e a genética devem ser casadas para melhor definição da conduta e maiores chances de sucesso no tratamento. O aconselhamento nutrigenético é uma realidade e cada vez mais pacientes beneficiam-se da nutrição de precisão.