A epilepsia é um distúrbio neurológico caracterizado por uma predisposição duradoura para convulsões. Afeta todas as faixas etárias, sendo um dos problemas neurológicos mais incapacitantes em crianças e idosos.
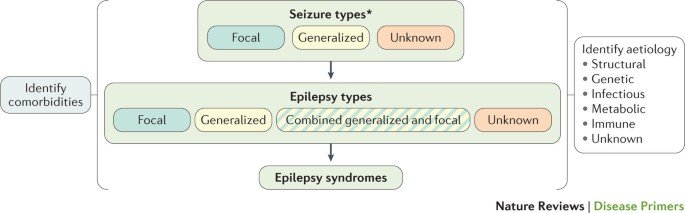
Uma crise epiléptica é uma mudança comportamental transitória, causada por atividade neuronal excessiva ou anormal no cérebro. O início da convulsão pode ser focal (quando a atividade neuronal anormal surge em uma ou mais regiões de um hemisfério cerebral), generalizada (quando a atividade neuronal anormal tem ampla distribuição em ambos os hemisférios cerebrais) ou de início desconhecido (sem identificação de início focal ou generalizado).
Para a avaliação do tipo de epilepsia, o neurologista analisará dados clínicos, a eletroencefalografia (EEG) e achados de neuroimagem. Avaliar a ocorrência é um processo desafiador, especialmente se o evento não foi testemunhado por outros ou se os relatos das testemunhas forem imprecisos. O médico precisará determinar se a convulsão foi provocada, reflexa ou aguda, como após hemorragia, traumatismo craniano, intoxicação. Crises sintomáticas agudas têm um risco menor de convulsões subsequentes. Nem todo paciente que convulsionou tem epilepsia.
Em todos os pontos durante o trabalho diagnóstico, o neurologista deverá tentar encontrar a etiologia do problema e procurar comorbidades, como dificuldades de aprendizagem e transtornos psiquiátricos, incluindo depressão e transtorno de ansiedade ou transtorno do espectro autista.
Muitos pacientes enfrentam desafios como acesso limitado a exames de EEG ou neuroimagem, falta de acesso à profissionais de saúde especializados para formular um diagnóstico preciso de epilepsia. Os erros de diagnóstico são comuns, e muitos pacientes não recebem o tratamento correto, que muitas vezes tem graves consequências sociais, mentais, de qualidade de vida e econômicas.
Causas das convulsões
Embora a causa da epilepsia em muitos pacientes seja desconhecida, as convulsões podem ser o resultado de quase qualquer insulto que perturbe a função cerebral.
Os insultos ao cérebro podem ser adquiridos (traumas, acidentes vasculares, infecções) ou decorrentes de problemas estruturais, genéticos, autoimunes ou metabólicos. Alguns modelos experimentais mostram uma redução na capacidade de produção do neurotransmissor inibitório ácido γ-aminobutírico (GABA).
A diminuição da atividade da enzima glutamina sintetase (que converte glutamato em glutamina) nos astrócitos reduz a conversão de glutamato (excitatório) em GABA, prejudicando o equilíbrio destes neurotransmissores. O aumento da atividade da adenosina quinase (AK) nos astrócitos reduz adenosina (inibitória) em torno das sinapses. Astrócitos e micróglia ativados liberam gliotransmissores e citocinas, que contribuem para a neuroinflamação. Estes mecanismos contribuem para convulsões espontâneas.
A microglia pode ser ativada por várias moléculas e sinais de perigo (como ATP e HMGB1), moléculas circulantes ou moléculas importados por leucócitos através da barreira hematoencefálica. A micróglia tem sido implicada na neurodegeneração induzida por convulsões e ATP).
Neurônios e astrócitos são as principais fontes de adenosina, com propriedades anticonvulsivantes. A adenosina inibe a liberação de glutamato, neurotransmissor excitatório (Tescarollo et al., 2020).
O glutamato aumenta ainda mais em casos de neuroinflamação. A inflamação cerebral crônica aumenta a sensibilidade dos receptores de glutamato e interfere na remoção de glutamato do espaço extraneuronal. Isto eleva o risco de excitotoxicidade por um período prolongado.
Tanto a neuroinflamação quanto o estresse oxidativo (que também inclui espécies reativas de nitrogênio geradas por sintase de óxido nítrico) têm sido implicados na morte, convulsões, epileptogênese e as comorbidades de epilepsia. Terapias anti-inflamatórias ou antioxidantes demonstraram eficácia em estudos preliminares em epilepsias pediátricas e adultas resistentes ao tratamento medicamentoso.
A neuroinflamação também causa disfunções na barreira hematoencefálica (BHE). A BHE é o sistema especializado de células endoteliais microvasculares cerebrais que protege o cérebro de substâncias tóxicas no sangue, fornece nutrientes aos tecidos cerebrais e filtra compostos nocivos do cérebro de volta à corrente sanguínea (Persidsky et al., 2006).
Disfunções da BHE podem influenciar a atividade e o início das convulsões, e as convulsões podem perpetuar o prejuízo à integridade da barreira. Assim, o tratamento da inflamação e a melhoria da capacidade de barreira emergem como terapias para alívio do impacto da epilepsia.
Outra causa das convulsões é a genética. Até o momento, mais de 500 genes associados à epilepsia foram identificados. A epilepsia focal – que representa 60% de todas as epilepsias – pode ser causada por mutações em vários genes, incluindo genes que codificam canais iônicos e genes que regular o crescimento celular.
A via da rapamicina (mTOR) foi implicada, e variantes patogenéticas podem resultam em lesões (como displasia cortical focal e malformações corticais) e epilepsia não lesional. Os genes da via mTOR que causam epilepsia focal incluem TSC1, TSC2, MTOR e os genes do complexo GATOR1 DEPDC5, NPRL2 e NPRL3.
Mecanismos epigenéticos também afetam a expressão gênica durante a epileptogênese e incluem metilação do DNA, modificação de histonas e expressão de microRNA (miRNA).
Sinais e sintomas das convulsões
Antes da crise convulsiva podem ocorrer mudanças de consciência, percepção sensorial ou alteração emocional. O paciente pode ter a sensação de que uma pessoa, lugar ou coisa é familiar (Déja vu), pode sentir odores, sons ou gostos diferentes, ter perda visual ou embaçamento da visão, sentimentos estranhos, medo, pânico ou devaneios, tontura, dor de cabeça, náuseas ou dormência em determinadas partes do corpo.
Durante a fase central da convulsão, até o fim da atividade convulsiva, há modificação da atividade elétrica do cérebro (visível no exame EEG) e o paciente pode apresentar perda de consciência, confusão mental, lapsos de memória, incapacidade de ouvir, sentir odores e gostos incomuns, ter perda momentânea de visão, ver luzes piscando, ter alucinações, sentir dormência ou formigamento no corpo, sentir pânico, medo, ter dificuldade para falar ou engolir, tremer (espasmos), rigidez muscular, perder momentaneamente o controle da urina ou das fezes, suar muito, ter dilatação de pupilas, dificuldade de respirar, enrolar ou morder a língua, sentir o coração acelerado.
Quando a convulsão termina (fase pós-ictal) vem o período de recuperação, que pode levar minutos ou horas. Neste período o paciente pode estar mais lento, sonolento, confuso, triste, assustado, frustrado, ansioso, envergonhado, nauseado. Alguns sentem sede, vontade de ir ao banheiro ou dor de cabeça. Se tiver caído pode ter algum ferimento a ser cuidado.
Tratamento da epilepsia
O cuidado de pacientes com epilepsia visa eliminar ou reduzir convulsões, minimizar os efeitos adversos do tratamento, tratar comorbidades médicas e neuropsiquiátricas e promover uma melhoria geral da qualidade de vida.
O tratamento de primeira linha para a epilepsia é o uso de anticonvulsivantes. Existem mais de 20 medicamentos aprovados. Mesmo assim, cerca de um terço dos pacientes não conseguem controlar as crises com o uso de múltiplas drogas.
O valproato é a terapia de primeira linha em pacientes com epilepsia generalizada idiopática, exceto em mulheres em idade fértil. Em crianças, etossuximida e valproato tiveram igual eficácia no controle das crises, e ambas as drogas foram superiores à lamotrigina. Lamotrigina e levetiracetam são mais bem tolerados do que carbamazepina em pacientes idosos.
Infelizmente, 80% dos pacientes relatam efeitos adversos com o uso da medicação, sendo que entre 30-40% dos pacientes terão efeitos colaterais que prejudicam substancialmente a qualidade de vida. Tais problemas podem ser minimizados com o início da terapêutica em doses baixas e aumento gradativo e lento.
Entre os efeitos colaterais da medicação estão: sedação, tontura, instabilidade, visão turva, diplopia e tremor, além de sintomas neurocognitivos e psiquiátricos (depressão, ansiedade, irritabilidade, alterações de humor, hiperatividade, raramente psicose).
Pacientes com histórico pessoal ou familiar de transtornos psiquiátricos ou deficiência intelectual têm um risco aumentado de efeitos adversos psiquiátricos com o tratamento medicamentoso. A longo prazo as medicações também podem gerar alterações metabólicas, neurológicas, hematológicas, dermatológicas, imunológicas.
O risco de fratura óssea aumenta em 2 a 3 vezes. O aumento de peso corporal e gordura são comuns em pacientes em uso de valproato, carbamazepina, gabapentina, pregabalina, vigabatrina e perampanel e pode levar a graves consequências para a saúde associadas à obesidade, aumento gordura abdominal, síndrome metabólica e aumento do risco de doença cardiovascular. Topiramato, zonisamida, felbamato, estiripentol e rufinamida) podem causar perda de peso, e alguns não influenciam o peso.
Epilepsia resistente a medicamentos
Aproximadamente 50% dos pacientes atingirão o controle das crises com a primeira medicação, outros 13% alcançarão o controle das convulsões após a segunda droga. Porém, cerca de 37% dos pacientes permanecerão com convulsões descontroladas, não importa quantos medicamentos sejam testados isoladamente ou de forma combinada (epilepsia farmacorresistente).
A epilepsia resistente a medicamentos está associada com maior risco de lesões e morte, maior carga de medicamentos e efeitos adversos, aumento de comorbidades psiquiátricas e neurocognitivas, redução das vantagens socioeconômicas e da qualidade de vida.
As opções de tratamento para epilepsia resistente a medicamentos incluem cirurgia, dispositivos de neuroestimulação e dieta cetogênica. Contudo, poucos pacientes são bons candidatos à cirurgia. Pacientes com esclerose mesial temporal, displasia cortical focal ou uma massa neocortical que possa ser completamente ressecada são fortes candidatos à cirurgia. Os riscos da cirurgia são déficits de memória ou linguagem por ressecções do hemisfério dominante, distúrbios do humor, dores de cabeça, infecções e acidentes vasculares cerebrais em uma minoria de pacientes.
Outra opção é a implantação de um dispositivo de neuroestimulação, como o estimulador de nervo vago (VNS) ou de núcleos da base. A estratégia pode reduzir em até 50% a frequência de convulsões, com melhor resultado se o paciente segue a dieta cetogênica.
A dieta cetogênica é o tratamento de escolha para alguns distúrbios metabólicos que podem causar epilepsia (como deficiência de GLUT1 e deficiência de piruvato desidrogenase) e pode ser eficaz para o paciente com epilepsia refratária.
Dieta cetogênica
Um terço dos pacientes continuará a ter convulsões durante a vida. A estratégia, neste caso, é a adoção da dieta cetogênica em uma de suas versões. A dieta cetogênica "clássica" é uma dieta especial com alto teor de gordura (85 a 90%), baixo teor de carboidratos e moderada em proteína (1,0g/Kg) que ajuda a controlar convulsões em pessoas com epilepsia, especialmente crianças. A dieta deve ser cuidadosamente monitorada por um nutricionista.
A dieta cetogênica clássica é mais rigorosa do que a dieta Atkins modificada (70% de gordura), exigindo medidas cuidadosas de calorias, líquidos e proteínas. Os alimentos são pesados e medidos.
O nome cetogênico significa que produz cetonas no corpo (ceto = cetona; gênico = produtor). As cetonas são formadas quando o corpo usa gordura como fonte de energia. Normalmente, o corpo usa carboidratos (proveniente de açúcar, pão, macarrão, arroz, frutas, batatas, leguminosas) como combustível. Como a dieta cetogênica é muito baixa em carboidratos, as gorduras se tornam o principal combustível.
As cetonas podem ser detectados na urina, sangue e respiração. São um dos mecanismos de ação mais prováveis da dieta, com níveis mais altos de cetonas geralmente levando a um melhor controle das convulsões. No entanto, existem muitas outras teorias sobre por que a dieta funcionará.
Se um paciente conseguia controlar as crises com a dieta cetogênica e volta a ter piora alguns pontos devem ser avaliados:
Acabar com as convulsões é a meta para pacientes epilépticos. As convulsões aumentam o risco de acidentes, de ansiedade, depressão. Além disso, convulsões prolongadas e recorrentes contribuem para a lesão de células nervosas, declínio cognitivo e redução da qualidade de vida.
Estudos tem mostrado que a associação de cetonas exógenas com triglicerídeos de cadeia média são as melhores opções para a redução destas crises (Brunner et al., 2021; D'Agostino et al., 2013; Kovács et al., 2017; Poff, Rho, & DÁgostino, 2019).
Aprenda mais sobre dieta cetogênica terapêutica na plataforma https://t21.video (curso para médicos e nutris iniciado, com uma aula nova por semana).
DIETA CETOGÊNICA PASSO A PASSO (para leigos).
Se você é profissional de saúde entre na plataforma t21.video