Músculos e fígado são órgãos reservatórios de energia na forma de carboidratos. Os mesmos vêm da dieta, a partir de consumo de alimentos como cereais, frutas e doces. Quanto mais carboidratos consumimos maior é a necessidade de insulina para que a glicose que chega ao sangue entre nas células. Mas, se os receptores de insulina não estiverem funcionando, a quantidade de açúcar no sangue sobe a níveis prejudiciais. Não temos como saber nossos níveis de açúcar no sangue sem avaliação. Existe aparelhos para automonitoramento, que são extremamente úteis:
Pessoas com glicose aumentada pode controlar seus níveis seguindo uma dieta com baixo teor de carboidratos ou mesmo cetogênica. A estratégia ajuda a reduzir o risco de doenças cardiovasculares, renais, nervosas…
Há apenas 50 anos, tínhamos um quarto da prevalência de DM2 que temos agora. Em grande parte dos países desenvolvidos quase metade dos adultos possuem resistência à insulina ou diabetes. O excesso de açúcar no sangue contribui para aumento do estresse oxidativo e da inflamação.
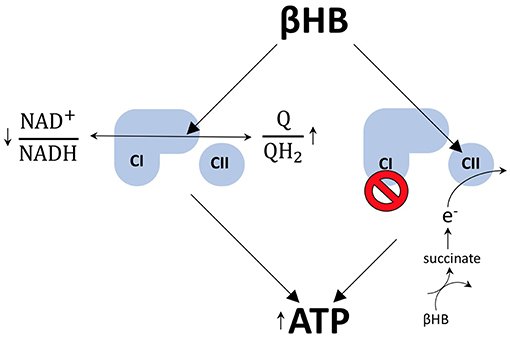
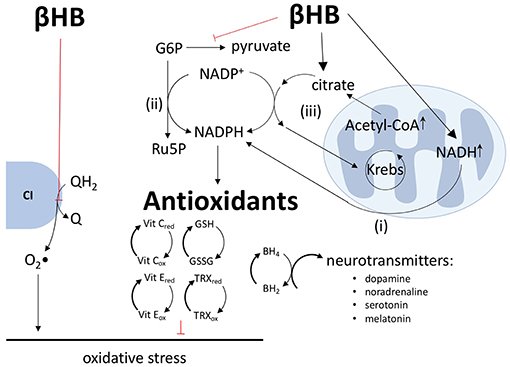
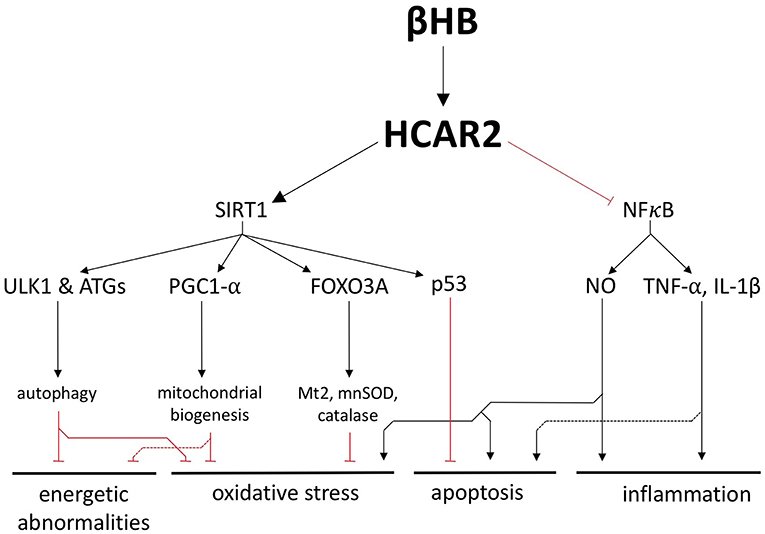
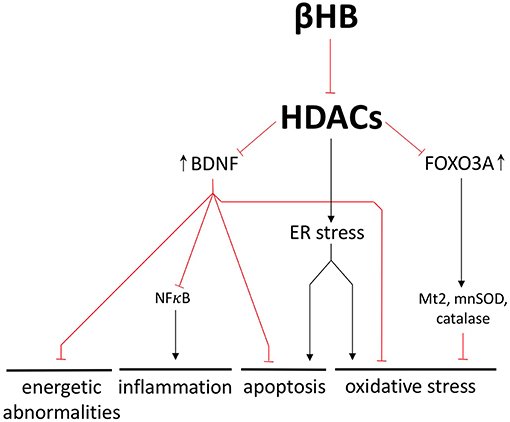
Ao adotar uma dieta restrita em carboidratos, o corpo é forçado a usar a gordura de estoque como forma de energia. No processo, produz corpos cetônicos, também chamados cetonas. Sabemos que cetonas nos níveis normais característicos da cetose nutricional reduzem o estresse oxidativo e a inflamação, e esses benefícios podem ser atribuídos à modulação de genes anti-envelhecimento.
Em estudo da Indiana University Health 262 pacientes com DM2 seguiram uma dieta cetogênica. Aos 70 dias, 92% conseguiram reduzir os valores de hemoglobina glicada (HbA1c) de 7,5% para 6,5%. Valores abaixo de 6,5% são considerados remissão do diabetes. Os medicamentos para diabetes foram reduzidos em mais de 45% e o peso diminuiu 7%.
Melhorar os biomarcadores de diabetes, como HbA1c por alguns meses ou até um ano, é bom. Fazer isso reduzindo o uso de medicamentos e reduzindo o excesso de peso é ainda melhor. Mas se estes benefícios não puderem ser sustentados, será apenas mais uma viagem de montanha-russa que tantas pessoas com diabetes tipo 2 já experimentaram.
A maioria das pessoas com DM2 foi educada para aumentar o exercício, evitar gorduras na dieta, comer “carboidratos saudáveis” e limitar as calorias. Mesmo seguindo estas orientações muitas pessoas não conseguem controlar as taxas de açúcar no sangue e acabam desenvolvendo complicações importantes.
Mas, estudos com dieta cetogênica demonstram que os pacientes conseguem controlar a glicemia por 1 ano, 2 anos, 5 anos, caso mantenham a estratégia de baixo consumo de carboidratos. Quer aprender mais? Acesse https://t21.video.