Nem sei quantas vezes já ouvi isso e, se isso é verdade para você, programe melhor suas refeições. Afinal, não adianta comer uma linda maçã e depois, voar em um pacote de biscoitos recheados.
Um dos motivos de frutas abrirem o apetite é o fato de serem ricas em açúcares naturais. Após a absorção deste açúcar a tendência é que a glicemia suba. Para reverter o processo, o pâncreas libera insulina na corrente sanguínea. Este hormônios abre as portas das células para o açúcar entrar. Com isso, a quantidade de glicose no sangue cai. Quando isto acontece, sentimos fomes novamente.
Assim, ao invés de comer a fruta sozinha, adicione à sua refeição algo com mais proteína e gordura. Esta estratégia fará a digestão ser mais lenta, o que contribui para a saciedade. Proteínas e gorduras também ajudam no controle da glicemia e dos níveis de insulina.
Você pode combinar a fruta com:
Ovos mexidos
Ovos de codorna
Iogurte proteico
Amêndoas ou castanhas
Pasta de amendoim sem açúcar
Você também pode optar por outros lanches saudáveis, como: (1) cenouras ou palitos de aipo com humos de grão de bico, (2) queijo cottage com frutas e nozes, (3) maçãs ou peras fatiadas com pasta de amendoim ou amêndoas, (4) iogurte proteico ou iogurte grego ou iogurte de coco com sementes (girassol, abóbora, chia, linhaça), (5) edamame, com castanhas e tangerina, (6) mix de castanha (caju, Pará, pistaches, nozes) e 2 quadrados de chocolate 85%, (7) ovos de codorna e fatias de pepino, (8) pão de linhaça e guacamole, (9) pão de psyllium e patê de atum, (10) snack de grão de bico torrado.
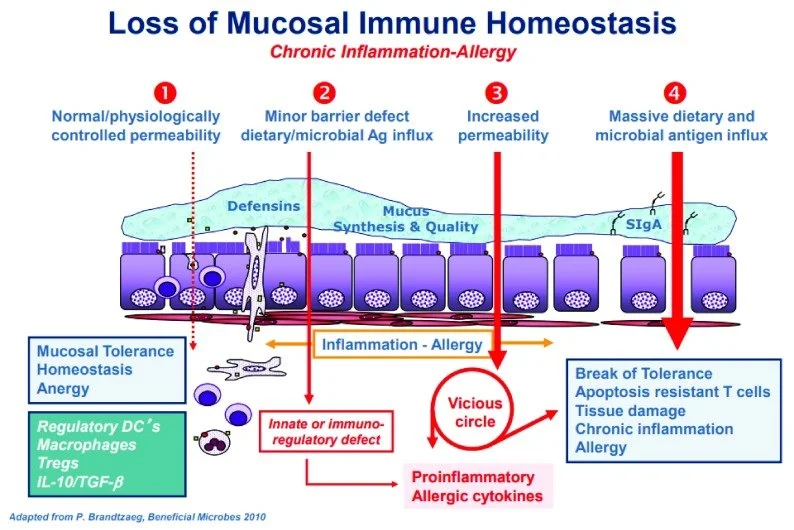
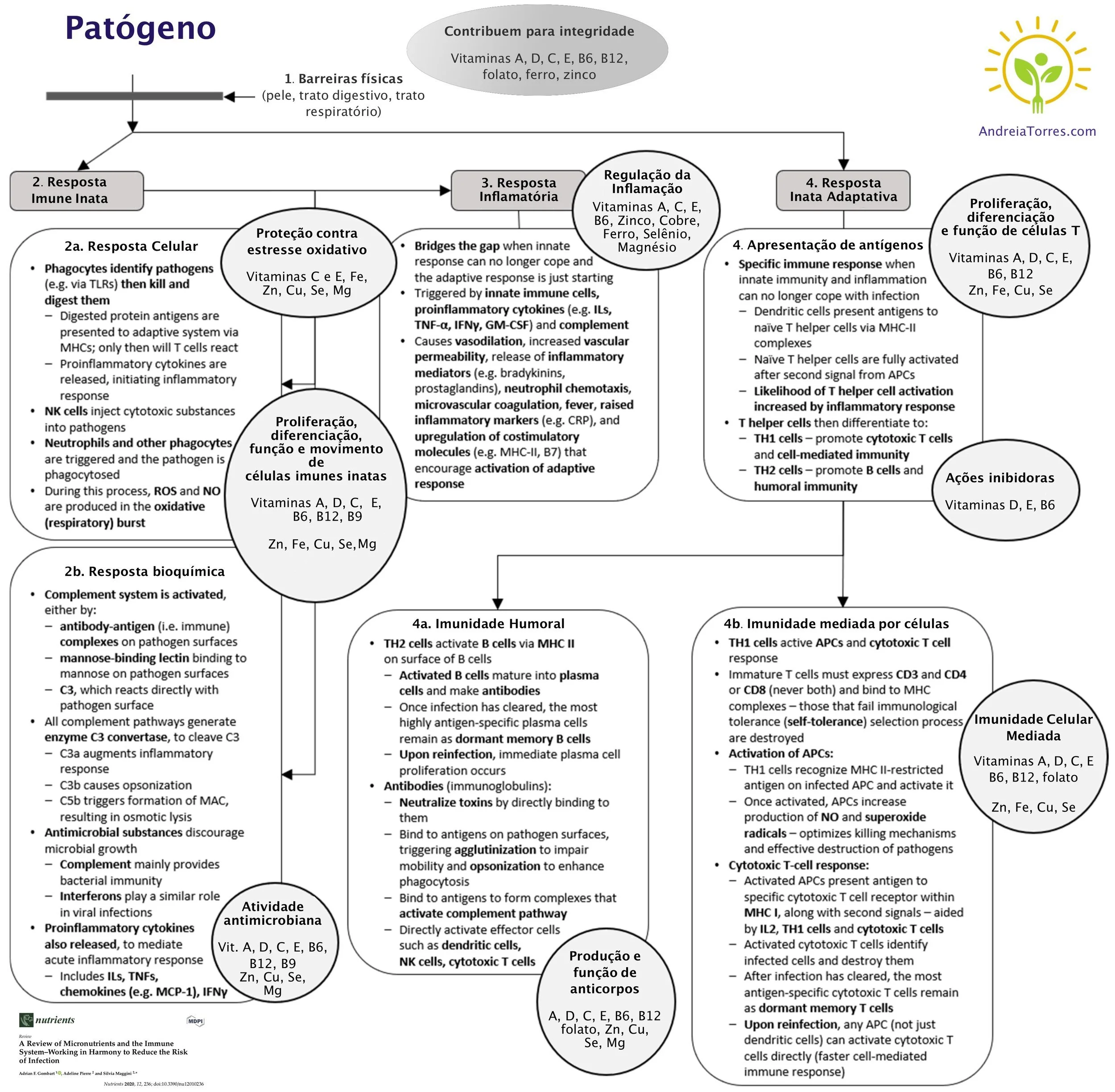
Estes lanches são ricos em fibras, contribuindo para um intestino saudável e uma microbiota feliz.