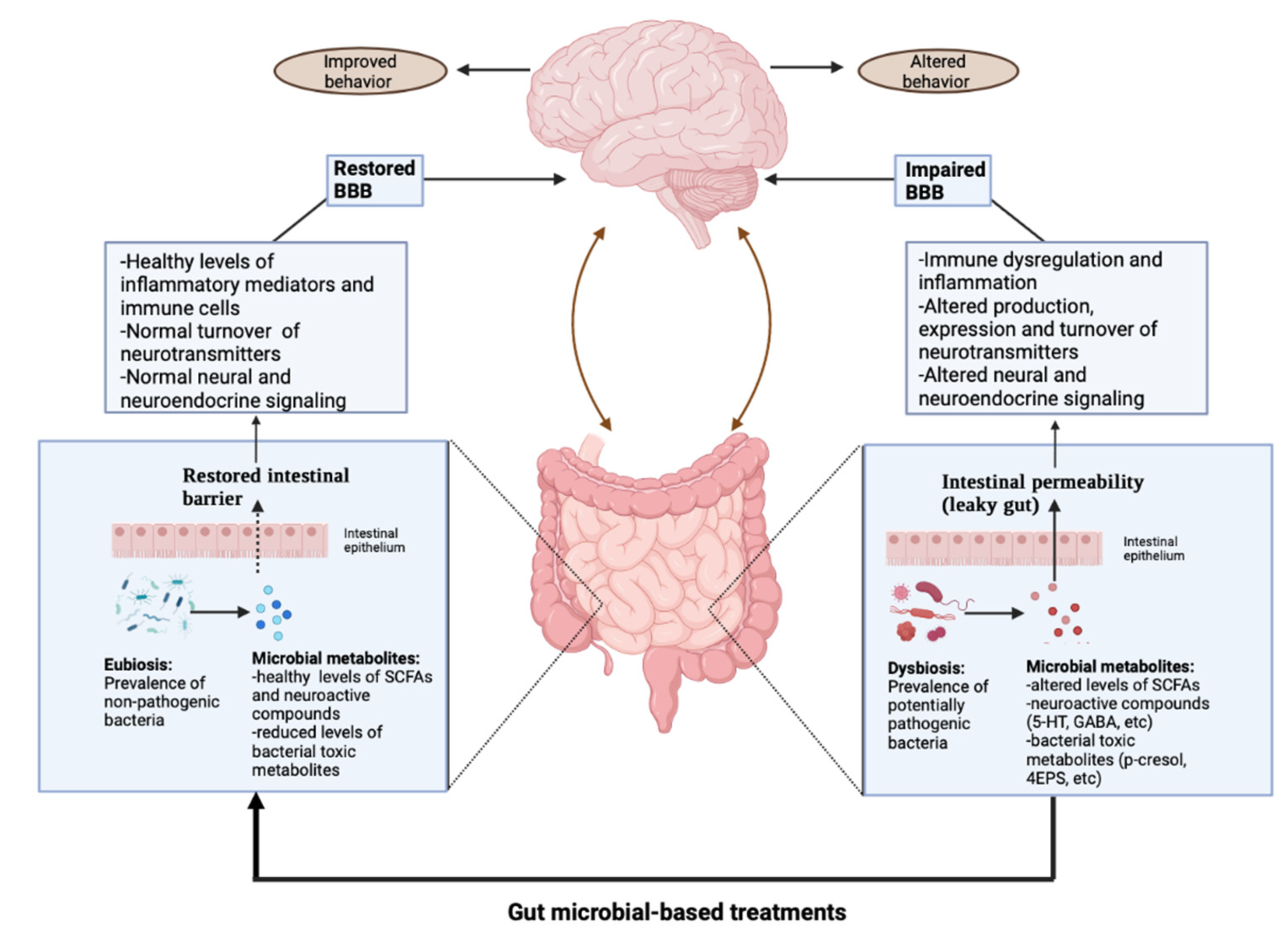
As questões de hipersensibilidade sensoriais no TEA têm relação com aquilo que chamamos de disfunção excitação/inibição, gerada, por exemplo, pelo aumento de glutamato e redução de GABA. Podemos, então, pensar na modulação GABAérgica do paciente.
Estudos mostraram uma possível ligação entre os níveis de Lactobacillus (como reuteri), os comportamentos relacionados ao TEA e o sistema GABAérgico, e sugeriram que essas bactérias podem regular a expressão dos receptores GABA no cérebro, secretando GABA, o neurotransmissor inibitório mais importante do SNC. Em camundongos, o aumento da expressão do receptor GABA no cérebro, associa-se a uma atenuação parcial de comportamentos antissociais e dos padrões repetitivos.
Outra possibilidade é o transplante de microbiota fecal (TMF), assegurando maior transferência de espécies bacterianas benéficos. Este tratamento apenas está aprovado no Brasil para o tratamento das infecções recorrentes e refratárias por Clostridium difficile, o que também é comum no TEA.
Em 2017, Kang e colaboradores avaliaram os efeitos de um protocolo de TMF na composição do microbioma intestinal e nos sintomas gastrointestinais e comportamentais do TEA em um estudo aberto envolvendo 18 crianças autistas com transtorno moderado e disfunções gastrointestinais graves. Os participantes receberam um tratamento de vancomicina de 2 semanas, uma limpeza intestinal e, em seguida, receberam por via oral ou retal uma dose alta de microbiota intestinal humana padronizada, seguida de doses orais diárias de manutenção mais baixas por 7–8 semanas.
Para definir se os efeitos do tratamento foram temporários ou duradouros, as respostas clínicas e a composição da microbiota intestinal foram monitorizadas durante um período adicional de acompanhamento de 8 semanas. Descobriu-se que tanto os comportamentos relacionados ao TEA quanto os sintomas gastrointestinais, especialmente dor abdominal, indigestão, diarréia e constipação, melhoraram significativamente no final do tratamento. O TMF resultou num aumento substancial na diversidade bacteriana intestinal e na contagem de bactérias benéficas, incluindo Bifidobacterium. Todos os efeitos benéficos foram mantidos após 8 semanas do final do tratamento e nenhum evento adverso grave foi descrito (Kang et al., 2017).
Dois anos mais tarde, os mesmos 18 indivíduos foram reavaliados num estudo de acompanhamento, a fim de investigar o impacto a longo prazo do MTT nos seus sintomas e no microbioma intestinal. Ao realizar os mesmos testes gastrointestinais e comportamentais empregados no ensaio original, observou-se que a redução dos sintomas gastrointestinais persistiu e a gravidade do TEA melhorou lenta e continuamente ao final do tratamento. Além disso, descreveram uma correlação positiva entre melhorias no IG e os principais sintomas do TEA, apoiando a hipótese de uma ligação clínica entre a saúde GI e o comportamento (Kang et al., 2019).
Outra opção para aumento de GABA é a suplementação de taurina sublingual (início com 50mg) ou L-theanina em doses mais elevadas. A fórmula pode ser associada à suplementação para neurotransmissão colinérgica, como Ment'active que pode inibir acetilcolinesterase com boa resposta. Outro produto interessante é o Brainfactor-7 (peptídio da seda), começando com 100mg ou magnésio L treonato, para melhoria do fluxo sanguineo cerebral.
Converse com um nutricionista e um neurologista para individualização.