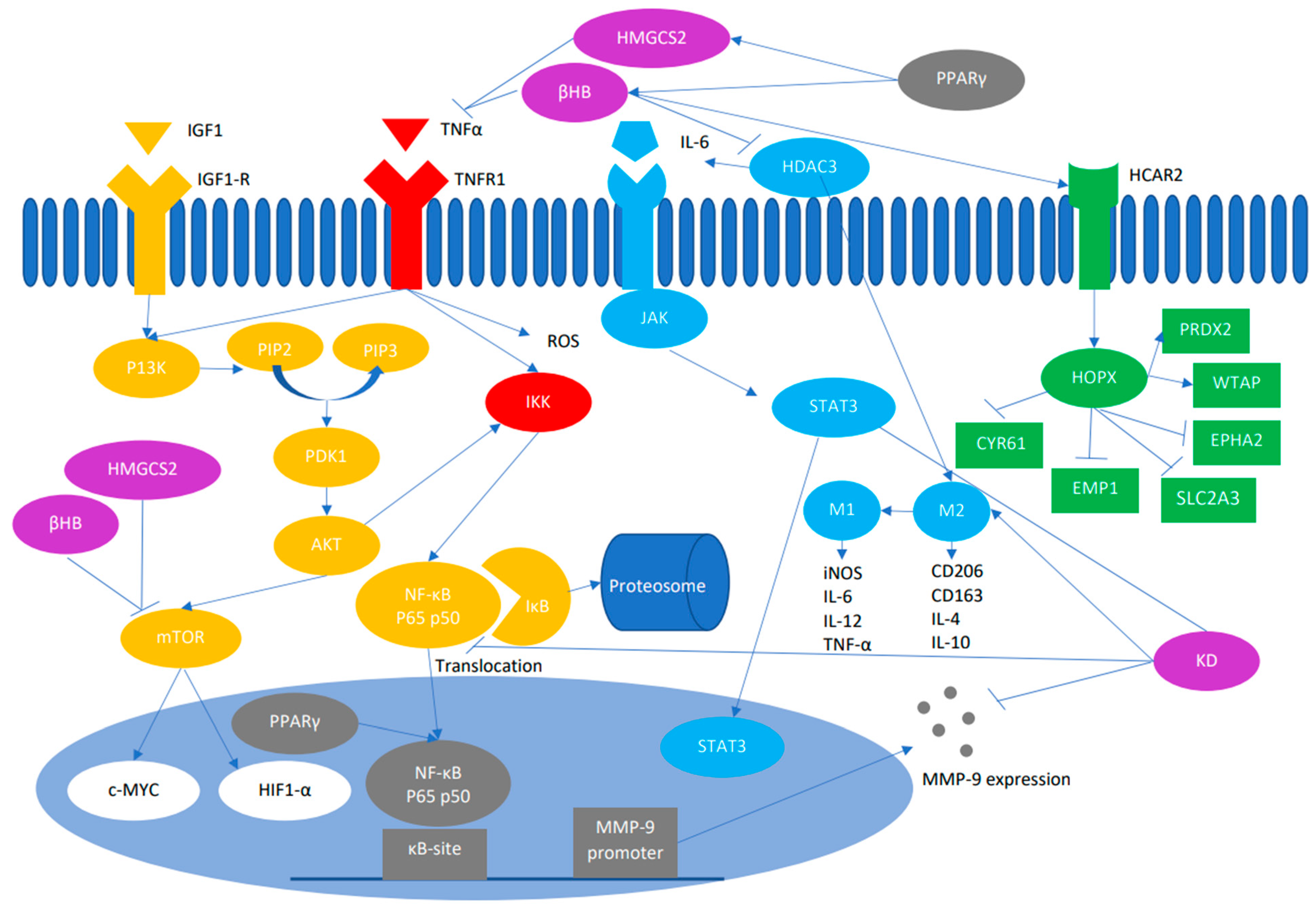
O NF-κB é uma proteína heterodímera composta por duas subunidades, p65 e p50, que são necessárias para ativar e translocar o NF-κB para o núcleo. Estímulos extracelulares, como um receptor do fator de necrose tumoral (em vermelho), interage com seu ligante TNF para regular positivamente o complexo IκB quinase (IKK).
O complexo IKK, por sua vez, fosforila o IκB ligado a p65/p50. O IκB fosforilado é degradado pela via ubiquitina-proteassoma, consequentemente ativando o NF-κB. O NF-κB ativado se transloca para o núcleo, onde ativa a expressão de genes a jusante que possivelmente aumenta a inflamação e a iniciação e progressão do câncer.
A ativação dessa via resulta no aumento da expressão de ciclina D1, ciclina E e quinase dependente de ciclina (CDK)-2, bem como de IL-6 e Myc. A IL-6 ativa transdutores de sinal e ativadores da transdução-3 (STAT3). A sinalização de IL-6/STAT3 tem uma consequência importante nas células imunes que se infiltram no tumor no microambiente imune do tumor no CRC [59].
A histona desacetilase 3 (via azul claro) controla a secreção de IL-6 e participa do aumento do fenótipo protumoral M2 do macrófago. Os macrófagos associados ao tumor (TAMs) são polarizados no M1, que são classicamente ativados e inibem o desenvolvimento do tumor ou no M2, que são alternativamente ativados e aumentam a progressão do tumor e a metástase.
O macrófago de fenótipo M1 aumentou a expressão de moléculas de óxido nítrico sintase induzível (iNOS), IL-12, MHC e CD16/32 e produziu fatores pró-inflamatórios, como IL-6, IL-12 e TNF-α, que pode iniciar a resposta imune. O fenótipo M2, por outro lado, produziu o receptor de Manose C tipo 1 (CD206), Cluster de diferenciações 163 (CD163), arginae-1, IL4 e IL10, que estão envolvidos na resposta anti-inflamatória e cura de feridas.
O NF-κB também está envolvido na expressão da metaloproteinase de matriz (MMP)-9 (Figura 2). A MMP9 é uma proteinase que pode digerir a matriz extracelular e as membranas basais e o colágeno tipo IV subjacente aos vasos sanguíneos, o que facilita a migração de cânceres agressivos.
In vivo, os corpos cetônicos minimizam a expressão da proteína MMP-9 e aumentam a polarização M2 para M1. Além disso, os níveis de proteínas HDAC3/PKM2/NF-κB 65/p-Stat3 diminuem no grupo em cetose.
Corpos cetônicos reduzem efeitos colaterais do tratamento
Oos efeitos colaterais da quimioterapia e da radioterapia podem ser muito incapacitantes e influenciar severamente a qualidade de vida. Alguns desses efeitos colaterais incluem náuseas, vômitos, fadiga, perda de cabelo, danos nos nervos e músculos, comprometimento cognitivo e perda de peso.
Uma dieta baixa em carboidratos e aumento de corpos cetônicos melhoraram a qualidade de vida, controlam os efeitos colaterais da quimioterapia, especificamente náusea e fadiga, e previnem a perda de massa muscular. Mas a qualidade da dieta é importante. Outra opção é suplementar ésteres de cetonas e triglicerídeos de cadeia média, capazes de aumentar corpos cetônicos no sangue, mesmo sem a restrição severa de carboidratos (Tamraz, Ghossaini, & Temraz, 2023).