O coração usa vários tipos de combustíveis para produzir ATP, a moeda energética das células. Não depende apenas de um tipo de substância, mas adapta-se de acordo com o que está disponível na circulação e com a sua atividade.
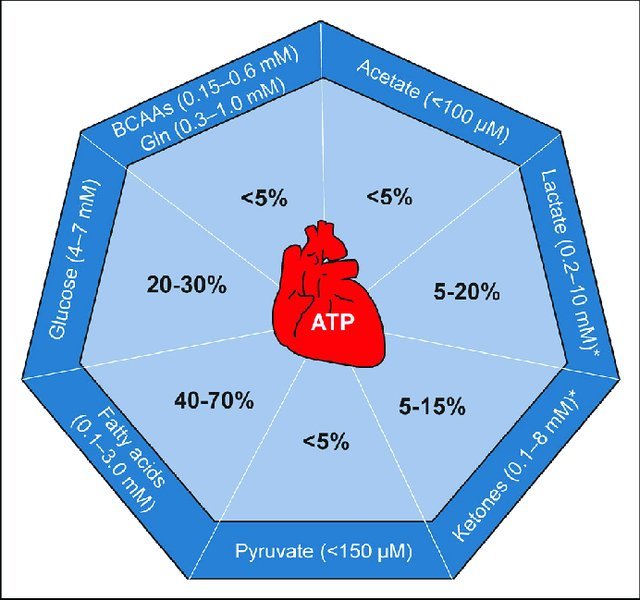
Principais substratos energéticos usados pelo coração
Na figura acima, é mostrada a dependência cardíaca (ou “peso” que cada substrato tem para produzir ATP) sob condições fisiológicas. Embora os valores exatos não sejam especificados aqui, a ideia principal é:
A maior fatia vem dos ácidos graxos.
Depois, glicose e lactato têm participação relevante.
Cetonas e BCAA têm uma contribuição menor, em condições basais.
Quando certos substratos se tornam mais importantes
Durante exercícios intensos: os níveis de lactato no sangue podem subir muito. Nesses momentos, o coração pode usar uma proporção maior de lactato para produzir ATP.
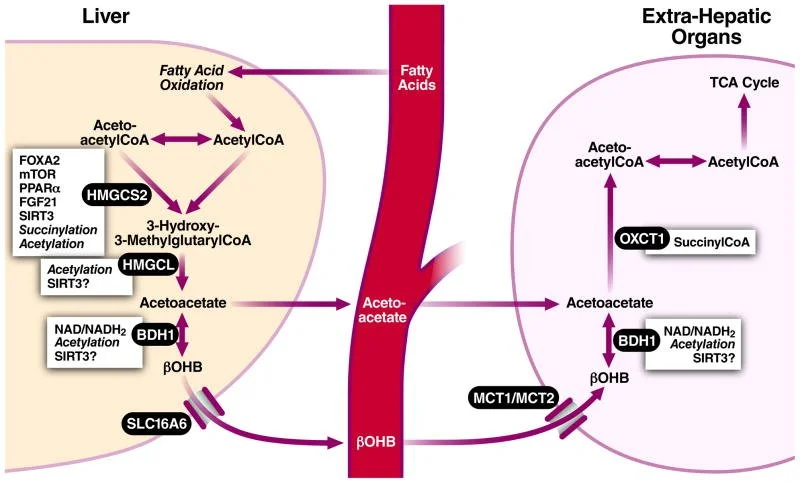
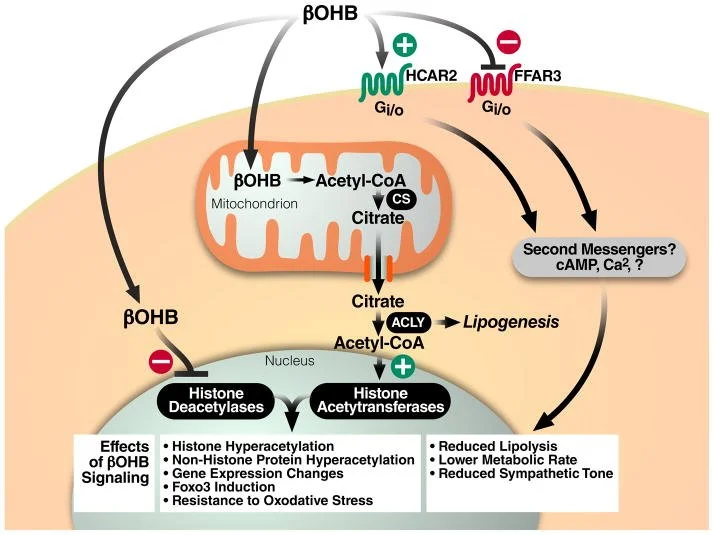
Em dietas específicas ou estados de jejum: os corpos cetônicos ficam mais elevados na circulação e são mais utilizados pelo coração.
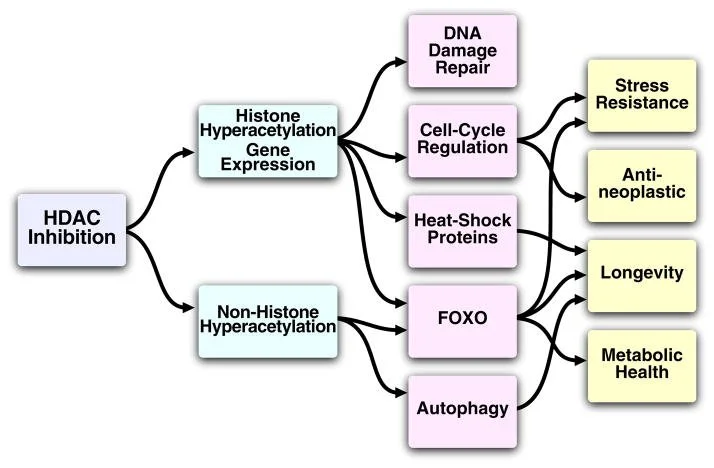
Em condições de doença cardíaca (como no remodelamento patológico): há uma reprogramação do metabolismo. Por exemplo, no coração hipertrofiado ou em insuficiência cardíaca, a utilização de ácidos graxos pode diminuir, enquanto a glicólise (uso da glicose) e a oxidação de cetonas aumentam.
A flexibilidade metabólica (capacidade do coração em usar diferentes combustíveis) é crucial para que o músculo cardíaco funcione bem e se adapte a diferentes situações (como exercício ou estresse).
Alterações no metabolismo cardíaco podem causar remodelamento patológico: se o coração passa a depender demasiado de glicose ou perde capacidade de usar ácidos graxos, isso pode contribuir para sua disfunção.