Corpos cetônicos são metabólitos hidrossolúveis produzidos no fígado a partir da β-oxidação de ácidos graxos quando a oferta de glicose é limitada ou a insulina está reduzida. Os três principais são acetoacetato, d-β-hidroxibutirato e acetona.
SÍNTESE DE CORPOS CETÔNICOS
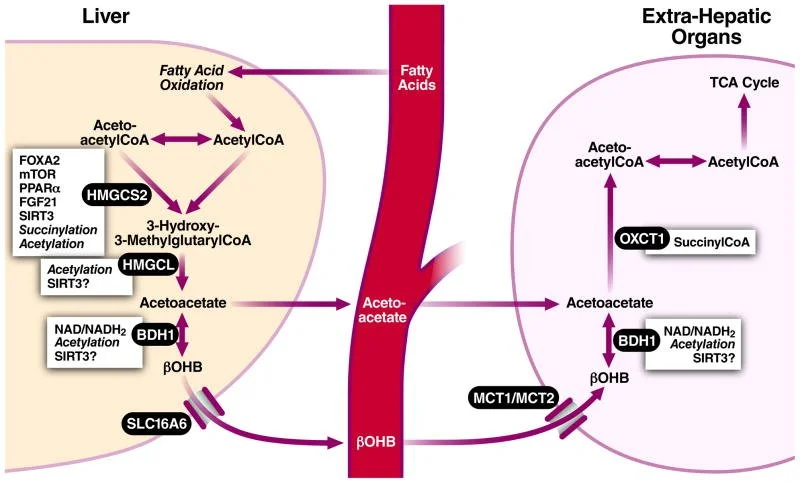
A síntese ocorre na matriz mitocondrial hepática a partir de acetil-CoA excedente. O acetoacetato é o produto primário, podendo ser reduzido a β-hidroxibutirato conforme a razão NADH/NAD+. A acetona é formada por descarboxilação espontânea do acetoacetato.
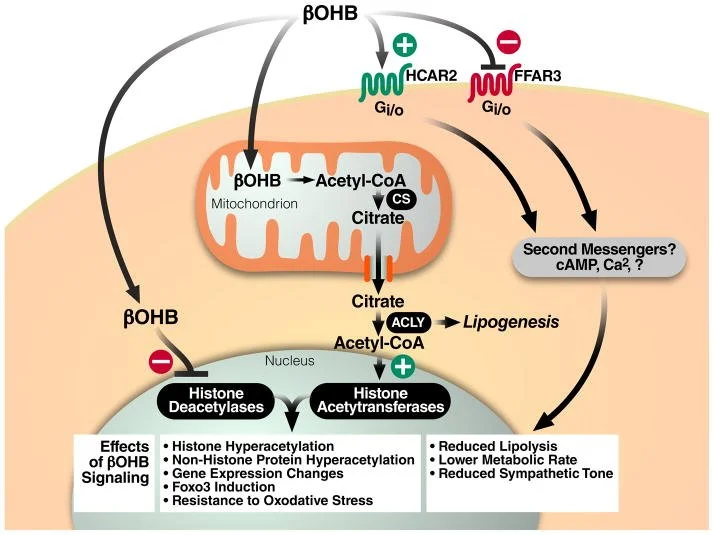
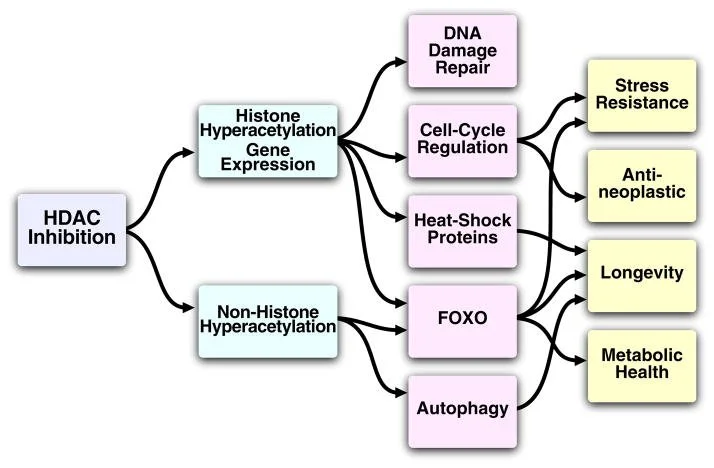
Tecidos extra-hepáticos reconvertem β-hidroxibutirato e acetoacetato em acetil-CoA via β-hidroxibutirato desidrogenase, succinil-CoA:acetoacetato transferase e tiolase, alimentando o ciclo de Krebs. Em condições fisiológicas, os corpos cetônicos funcionam como combustível de alta eficiência, com maior rendimento energético por molécula de oxigênio que o piruvato. Além da função bioenergética, β-hidroxibutirato atua como molécula sinalizadora que modula vias redox, inflamatórias e epigenéticas, incluindo inibição de HDACs e β-hidroxibutirilação de histonas.
BENEFÍCIOS DA CETOSE
A cetose leve modula vias metabólicas centrais com impacto direto sobre homeostase energética, sinalização redox e eficiência mitocondrial. O d-beta-hidroxibutirato apresenta densidade energética superior ao piruvato e amplia o DeltaG' da hidrólise de ATP, favorecendo tecidos submetidos a estresse bioenergético. Essa característica fundamenta seu potencial terapêutico em condições marcadas por limitação de substrato, disfunção insulínica, dano oxidativo e hipóxia celular.
Em estados de resistência à insulina, a oferta de corpos cetônicos contorna bloqueios na entrada de glicose e assegura suprimento estável de acetil-CoA para o ciclo de Krebs, reduzindo dependência de vias glicolíticas comprometidas. O perfil redox gerado pelo beta-hidroxibutirato modula a razão NADH/NAD+, estabiliza o potencial mitocondrial e atenua formação de espécies reativas de oxigênio, o que influencia patologias guiadas por estresse oxidativo crônico. Em cenários hipóxicos, a eficiência termodinâmica da oxidação cetônica preserva gradientes eletroquímicos e sustenta produção de ATP mesmo sob limitação parcial de oxigênio.
As dietas cetogênicas tradicionais elevam ácidos graxos livres e ativam PPAR, estimulando proteínas desacopladoras que reduzem eficiência mitocondrial. Estratégias nutricionais baseadas em corpos cetônicos exógenos ou ésteres cetônicos contornam essa limitação, permitindo indução de cetose terapêutica sem sobrecarga lipídica. Esse modelo favorece aplicações clínicas mais precisas, desde distúrbios metabólicos comuns até doenças raras associadas a falhas na fosforilação oxidativa.
A convergência entre maior rendimento energético, modulação redox favorável e redução da glicotoxicidade posiciona a cetose leve como intervenção metabólica com amplo potencial translacional.
Tradicionalmente, o corpo cetônico β-hidroxibutirato (βOHB) tem sido considerado um transportador de energia do fígado para os tecidos periféricos durante o jejum ou exercício. No entanto, βOHB também sinaliza via receptores extracelulares e atua como um inibidor endógeno de histonas desacetilases (HDACs). Essas descobertas recentes suportam um modelo no qual o βOHB funciona para ligar o ambiente, neste caso a dieta, e a expressão gênica por meio de modificações da cromatina. Revisamos a regulação e as funções dos corpos cetônicos, a relação entre os corpos cetônicos e a restrição calórica e as implicações da inibição do HDAC pelo corpo cetônico βOHB na modulação do metabolismo e nas doenças do envelhecimento.