Recebi esta pergunta de uma paciente. A questão de saber se ter um dos pais com doença de Parkinson aumenta o risco para os filhos é abordada em diversos estudos, embora dados específicos sobre herança materna sejam limitados.
A doença de Parkinson (DP) é uma doença neurodegenerativa complexa com etiologia multifatorial, incluindo fatores genéticos e ambientais. Um estudo envolvendo 100 pacientes com doença de Parkinson e seus cônjuges como controles constatou que ter histórico familiar de doença de Parkinson aumenta significativamente o risco. A razão de chances para doença de Parkinson familiar foi de 13,4, indicando um forte componente genético. O estudo também observou que casos secundários foram mais frequentes na linha paterna do que na materna, sugerindo um potencial padrão de herança autossômica dominante com penetrância incompleta [1].
Outro estudo examinou o histórico familiar em 100 casos consecutivos de doença de Parkinson e constatou que 24% tinham histórico familiar positivo para doença de Parkinson, em comparação com 6% dos cônjuges controles. Este estudo corrobora a noção de herança autossômica dominante com penetrância relacionada à idade, embora não especifique herança materna versus paterna [2].
Pesquisas sobre antecipação genética na doença de Parkinson mostraram que indivíduos com pais, tios ou tias afetados apresentaram início mais precoce da doença em comparação com aqueles com irmãos afetados ou sem parentes afetados. Isso sugere um componente genético que pode afetar a idade de início, mas não aborda especificamente a herança materna [3].
Assim, ter um dos pais com doença de Parkinson aumenta o risco para os filhos, provavelmente devido a fatores genéticos. A razão de chances para doença de Parkinson familiar é notavelmente alta, indicando uma influência genética significativa [1] [2].
Embora estudos sugiram um padrão de herança autossômica dominante, há dados limitados comparando especificamente a herança materna versus paterna. No entanto, algumas evidências apontam para uma maior frequência de casos na linha paterna [1].
No geral, os estudos disponíveis indicam que ter um dos pais com doença de Parkinson aumenta o risco para os filhos, embora dados específicos sobre herança materna não sejam extensivamente abordados nos resultados obtidos. O risco maior ocorre em famílias onde há vários casos de Parkinson ou quando a doença começa muito cedo (antes dos 50 anos). Contudo, na maioria dos casos, o Parkinson não é diretamente hereditário. Fatores ambientais e de estilo de vida também influenciam.
Fatores de risco ambientais na doença de Parkinson
Dentre os fatores de risco modificáveis mais estudados estão:
1) Contato com pesticidas
Pesticidas têm sido consistentemente associados a um risco aumentado de DP. O estudo Geoparkinson, que incluiu 959 casos de parkinsonismo e 1989 controles em cinco países europeus, encontrou uma relação significativa entre exposição e resposta a pesticidas, com níveis mais elevados de exposição correlacionando-se com maiores chances de desenvolver DP (OR = 1,41 para alta exposição) [4].
Um estudo de caso-controle em Taiwan também destacou a associação significativa entre DP e o uso de herbicidas/pesticidas, particularmente paraquate, mostrando uma relação dose-resposta [5].
Uma revisão narrativa enfatizou que a exposição a pesticidas é um fator de risco bem fundamentado para DP, com substâncias químicas específicas como rotenona e paraquate sendo fortemente associadas ao aumento do risco de DP [6].
A vida rural e o consumo de água de poço foram identificados como potenciais fatores de risco. Um estudo na Itália descobriu que o uso de água de poço estava positivamente associado à DP (OR = 2,0) [7]. Da mesma forma, um estudo na Finlândia observou que o consumo de água de poço aumentou significativamente entre pacientes com DP [8]. Outro estudo indicou que a exposição prolongada à água de poço (≥ 40 anos) estava associada a um maior risco de DP (OR = 7,1) [9].
2) Traumatismo craniano
O traumatismo craniano tem sido implicado como um fator de risco para DP. O estudo Geoparkinson relatou probabilidades aumentadas de DP com histórico de perda de consciência, com incidentes repetidos apresentando risco ainda maior (OR = 2,53 para mais de uma ocorrência) [4]. Um estudo na Nova Inglaterra encontrou um risco quatro vezes maior de DP associado a traumatismo craniano ou concussão prévios [10].
3) Exposições Ocupacionais e Químicas
A exposição ocupacional a certos produtos químicos tem sido associada à DP. Um estudo no Canadá encontrou associações significativas entre DP e exposição a resinas plásticas, resinas epóxi, colas, tintas e derivados de petróleo [11].
O estudo Geoparkinson também examinou a exposição a metais como ferro, cobre e manganês, embora as evidências de que metais sejam fatores de risco para DP permaneçam inconclusivas [4].
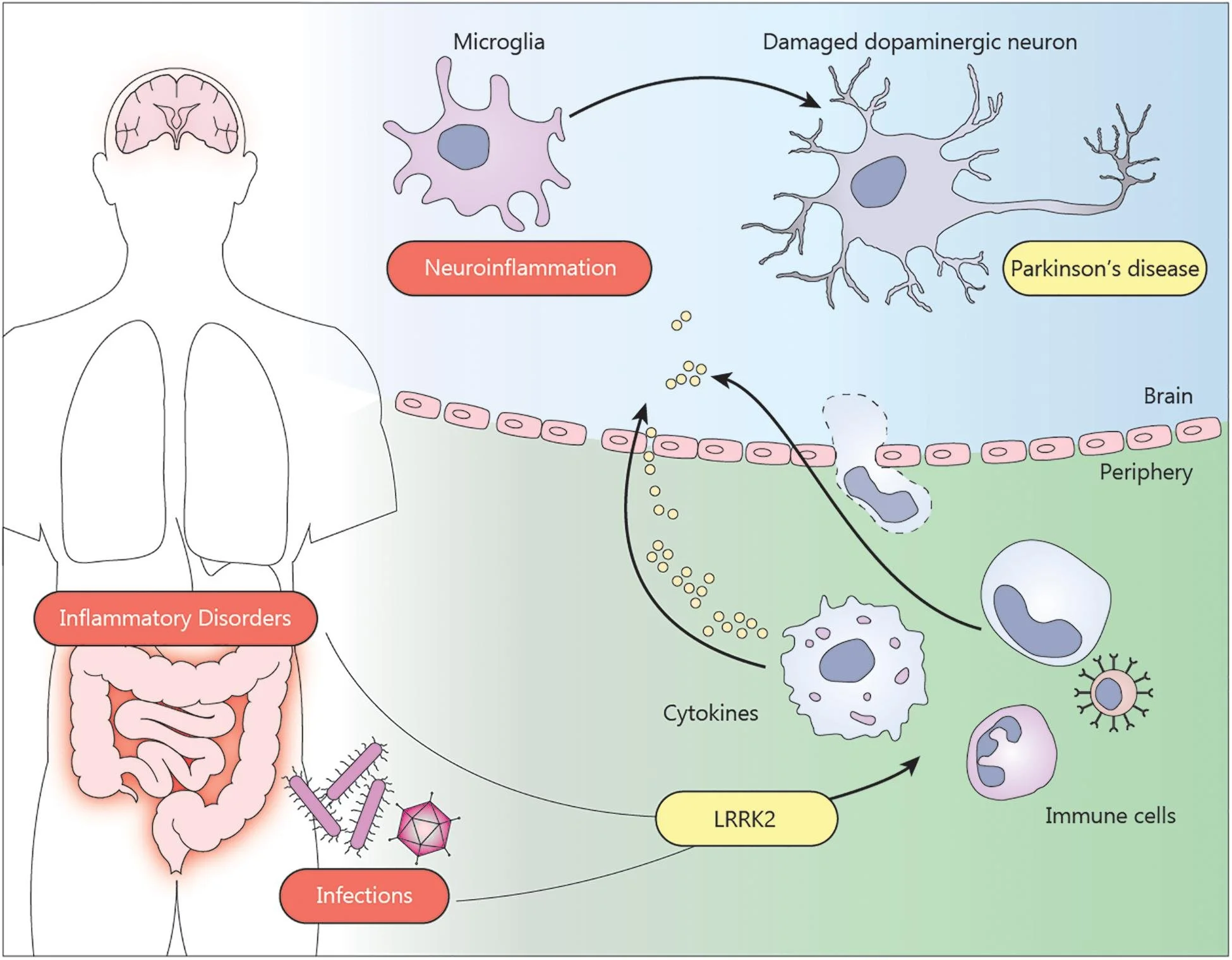
4) Disbiose intestinal
Estudos têm demonstrado consistentemente alterações na microbiota intestinal de pacientes com DP em comparação com controles saudáveis. Alterações notáveis incluem:
Aumento da Abundância: Famílias como Bifidobacteriaceae, Verrucomicrobiaceae e Christensenellaceae são encontradas em maior abundância em pacientes com DP [12] [13]. A abundância de certas famílias bacterianas correlaciona-se com os fenótipos motores da DP, como instabilidade postural e dificuldade de marcha [15].
Diminuição da Abundância: Prevotellaceae e Lachnospiraceae, importantes para a produção de ácidos graxos de cadeia curta, estão reduzidas em pacientes com DP [14] [15].
Gêneros Específicos: Gêneros como Lactobacillus, Akkermansia e Bifidobacterium são enriquecidos, enquanto Faecalibacterium e Clostridium são diminuídos [16] [14].
A hipótese sugere que a disbiose (desequilíbrio) da microbiota intestinal pode desencadear inflamação, o que pode promover o desenvolvimento da DP. Citocinas pró-inflamatórias, como o fator de necrose tumoral e a interleucina-1β, estão elevadas na DP, correlacionando-se com alterações na microbiota intestinal [17].
Alterações na microbiota intestinal podem levar a um estado pró-inflamatório, contribuindo para os sintomas gastrointestinais da DP e potencialmente afetando a progressão da doença [14] [18].
A DP é caracterizada por comorbidades gastrointestinais, como constipação e tempo de trânsito colônico reduzido. A composição alterada da microbiota está associada a esses sintomas, sugerindo uma ligação mecanicista entre o metabolismo bacteriano e a saúde intestinal [19].
Fatores de Proteção
A modulação intestinal está sendo explorada, enfatizando a importância do eixo intestino-cérebro [20].
De forma muito estranha, o tabagismo tem sido consistentemente relatado como um fator de proteção contra DP. Vários estudos, incluindo aqueles conduzidos na França e na Itália, observaram uma relação inversa entre tabagismo e risco de DP [21] [22]. Porém, não recomenda-se que ninguém comece a fumar, uma vez que o tabagismo é fator de risco é associado a uma série de outras doenças.
Precisa de ajuda? Marque aqui sua consulta de nutrição online
Referências
1) G De Michele et al. A genetic study of Parkinson's disease. Journal of neural transmission. Supplementum (1995). https://pubmed.ncbi.nlm.nih.gov/8748605/
2) V Bonifati et al. Familial Parkinson's disease: a clinical genetic analysis. The Canadian journal of neurological sciences. Le journal canadien des sciences neurologiques (1995). https://pubmed.ncbi.nlm.nih.gov/8599769/
3) H Payami et al. Genetic anticipation in Parkinson's disease. Neurology (1995). https://pubmed.ncbi.nlm.nih.gov/7824103/
4) FD Dick et al. Environmental risk factors for Parkinson's disease and parkinsonism: the Geoparkinson study. Occupational and environmental medicine (2007). https://pubmed.ncbi.nlm.nih.gov/17332139/
5) HH Liou et al. Environmental risk factors and Parkinson's disease: a case-control study in Taiwan. Neurology (1997). https://pubmed.ncbi.nlm.nih.gov/9191770/
6) S Nandipati et al. Environmental Exposures and Parkinson's Disease. International journal of environmental research and public health (2016). https://pubmed.ncbi.nlm.nih.gov/27598189/
7) M Zorzon et al. Familial and environmental risk factors in Parkinson's disease: a case-control study in north-east Italy. Acta neurologica Scandinavica (2002). https://pubmed.ncbi.nlm.nih.gov/11903115/
8) W Koller et al. Environmental risk factors in Parkinson's disease. Neurology (1990). https://pubmed.ncbi.nlm.nih.gov/2381528/
9) JM Wright et al. Environmental determinants of Parkinson's disease. Archives of environmental & occupational health (2006). https://pubmed.ncbi.nlm.nih.gov/16961006/
10) AS Andrew et al. Lifestyle Factors and Parkinson's Disease Risk in a Rural New England Case-Control Study. Parkinson's disease (2021). https://pubmed.ncbi.nlm.nih.gov/34306610/
11) S Chaturvedi et al. Environmental exposures in elderly Canadians with Parkinson's disease. The Canadian journal of neurological sciences. Le journal canadien des sciences neurologiques (1995). https://pubmed.ncbi.nlm.nih.gov/8529177/
12) EM Hill-Burns et al. Parkinson's disease and Parkinson's disease medications have distinct signatures of the gut microbiome. Movement disorders : official journal of the Movement Disorder Society (2017). https://pubmed.ncbi.nlm.nih.gov/28195358/
13) S Zhou et al. Meta-analysis of the relations between gut microbiota and pathogens and Parkinson's disease. Advances in clinical and experimental medicine : official organ Wroclaw Medical University (2023). https://pubmed.ncbi.nlm.nih.gov/36881358/
14) S Romano et al. Meta-analysis of the Parkinson's disease gut microbiome suggests alterations linked to intestinal inflammation. NPJ Parkinson's disease (2021). https://pubmed.ncbi.nlm.nih.gov/33692356/
15) F Scheperjans et al. Gut microbiota are related to Parkinson's disease and clinical phenotype. Movement disorders : official journal of the Movement Disorder Society (2014). https://pubmed.ncbi.nlm.nih.gov/25476529/
16) T Ji et al. Leveraging sequence-based faecal microbial community survey data to identify alterations in gut microbiota among patients with Parkinson's disease. The European journal of neuroscience (2020). https://pubmed.ncbi.nlm.nih.gov/32865266/
17) G Xiromerisiou et al. Parkinson's Disease, It Takes Guts: The Correlation between Intestinal Microbiome and Cytokine Network with Neurodegeneration. Biology (2023). https://pubmed.ncbi.nlm.nih.gov/36671785/
18) AO Omotosho et al. Parkinson's disease: Are gut microbes involved?. Brain and behavior (2023). https://pubmed.ncbi.nlm.nih.gov/37340511/
19) MS Cirstea et al. Microbiota Composition and Metabolism Are Associated With Gut Function in Parkinson's Disease. Movement disorders : official journal of the Movement Disorder Society (2020). https://pubmed.ncbi.nlm.nih.gov/32357258/
20) Z Zhao et al. Microbial biomarker discovery in Parkinson's disease through a network-based approach. NPJ Parkinson's disease (2024). https://pubmed.ncbi.nlm.nih.gov/39461950/
21) PM Preux et al. Parkinson's disease and environmental factors. Matched case-control study in the Limousin region, France. Neuroepidemiology (2000). https://pubmed.ncbi.nlm.nih.gov/11060508/
22) G De Michele et al. Environmental and genetic risk factors in Parkinson's disease: a case-control study in southern Italy. Movement disorders : official journal of the Movement Disorder Society (1996). https://pubmed.ncbi.nlm.nih.gov/8771062/