A doença de Parkinson (DP) é um distúrbio neurodegenerativo progressivo caracterizado principalmente por sintomas motores e não motores. Sua fisiopatologia envolve alterações complexas nos sistemas nervoso central e periférico, destacando-se a degeneração de neurônios dopaminérgicos na substância negra pars compacta do cérebro.
Principais aspectos da fisiopatologia da DP:
1. Degeneração dos neurônios dopaminérgicos
Os neurônios da substância negra pars compacta, que enviam projeções ao estriado (composto pelo putâmen e núcleo caudado), sofrem degeneração.
A redução de dopamina no estriado resulta em um desequilíbrio funcional nos circuitos dos gânglios da base, afetando o controle motor.
O sistema excitatório e inibitório é desregulado, levando a sintomas como tremor, rigidez, bradicinesia e instabilidade postural.
2. Acúmulo de corpos de Lewy
Ocorre o acúmulo anormal da proteína α-sinucleína dentro dos neurônios, formando agregados tóxicos, como oligômeros e fibrilas. Estes agregados são o passo inicial do processo patológico da DP.
Os agregados proteicos contribuem para a disfunção e morte celular, não apenas em áreas motoras, mas também em outras regiões cerebrais, causando sintomas não motores.
Com o tempo, os agregados de α-sinucleína se acumulam ainda mais e formam estruturas maiores e mais complexas, que são os corpos de Lewy.
Os corpos de Lewy são inclusões intracelulares maduras e bem organizadas, resultado da progressão do processo patológico. Contêm principalmente α-sinucleína, mas também outras proteínas mal dobradas, lipídeos e componentes celulares.
3. Danos em outros sistemas neurológicos
Além dos gânglios da base, outras áreas do sistema nervoso central e periférico são afetadas:
Tronco encefálico (ex.: núcleo dorsal da rafe e locus coeruleus).
Córtex cerebral, em estágios avançados.
Sistema nervoso autônomo, relacionado a sintomas como constipação e hipotensão postural.
4. Disfunção mitocondrial e estresse oxidativo
A função mitocondrial é comprometida nos neurônios dopaminérgicos, gerando excesso de radicais livres.
Causas: Exposição a toxinas, envelhecimento, ou mutações em genes relacionados à DP, como PRKN, PINK1 e DJ1.
Efeitos: O dano mitocondrial causa:
Redução da produção de ATP (energia celular).
Aumento de espécies reativas de oxigênio (ROS, radicais livres).
Elevação dos níveis intracelulares de cálcio (Ca²⁺), levando à disfunção neuronal.
Danos às proteínas, lipídeos e DNA celular, acelerando a degeneração neuronal.
5. Inflamação neurogênica
A ativação de células da glia (como micróglias e astrócitos) promove a liberação de citocinas inflamatórias, contribuindo para a disfunção sináptica e a morte neuronal.
6. Disfunção no clearance de proteínas
A capacidade de eliminar proteínas defeituosas ou mal dobradas é comprometida devido à:
Alteração nos proteassomos: Estruturas que degradam proteínas defeituosas.
Autofagia prejudicada: O sistema de limpeza lisossomal (responsável por reciclar componentes celulares) é comprometido, especialmente por mutações em genes como GBA ou ATP13A2.
Manifestação clínica correlacionada à fisiopatologia
Sintomas motores:
Resultam do desequilíbrio dopaminérgico nos circuitos dos gânglios da base.
Exemplos: tremor de repouso, rigidez, bradicinesia e instabilidade postural.
Sintomas não motores:
Ligados a áreas extramotoras do cérebro e sistema nervoso periférico:
Disfunções olfatórias (envolvimento do bulbo olfatório).
Distúrbios do sono REM.
Alterações autonômicas (ex.: hipotensão, constipação).
Sintomas cognitivos e psiquiátricos (ex.: depressão, ansiedade).
Tratamento da doença de Parkinson
O tratamento da doença de Parkinson (DP) tem como objetivo principal controlar os sintomas (motores e não motores) e melhorar a qualidade de vida dos pacientes, uma vez que ainda não há cura ou terapias capazes de interromper a progressão da doença. A abordagem é personalizada, considerando fatores como idade, estágio da doença e tolerância aos medicamentos.
1. Tratamento farmacológico
Os medicamentos utilizados atuam principalmente para repor dopamina ou corrigir o desequilíbrio nos circuitos dos gânglios da base.
a) Levodopa (L-DOPA)
Mecanismo: É o precursor da dopamina, que atravessa a barreira hematoencefálica e é convertida em dopamina nos neurônios.
Uso combinado:
Sempre administrada com inibidores da dopa-descarboxilase periférica (como carbidopa ou benserazida) para evitar a conversão precoce de levodopa em dopamina fora do cérebro.
Eficácia: É o tratamento mais eficaz para os sintomas motores, como bradicinesia e rigidez.
Efeitos adversos:
A longo prazo, pode causar flutuações motoras (ex.: períodos "on-off") e discinesias (movimentos involuntários).
b) Agonistas dopaminérgicos
Exemplos: Pramipexol, ropinirol, rotigotina (transdérmica) e apomorfina.
Mecanismo: Estimulam diretamente os receptores de dopamina.
Indicação:
Alternativa à levodopa em estágios iniciais, especialmente em pacientes jovens.
Usados em combinação com levodopa em estágios avançados.
Efeitos adversos: Sonolência, alucinações, comportamentos compulsivos (ex.: jogo, compras).
c) Inibidores da MAO-B
Exemplos: Selegilina, rasagilina, safinamida.
Mecanismo: Inibem a enzima monoamina oxidase tipo B (MAO-B), que degrada a dopamina no cérebro, prolongando sua ação.
Indicação: Estágios iniciais ou como adjuvantes à levodopa.
d) Inibidores da COMT
Exemplos: Entacapona, tolcapona, opicapona.
Mecanismo: Inibem a enzima catecol-O-metiltransferase (COMT), prolongando o efeito da levodopa.
Indicação: Reduzem as flutuações motoras em pacientes tratados com levodopa.
e) Anticolinérgicos
Exemplos: Trihexifenidil, biperideno.
Mecanismo: Reduzem a hiperatividade colinérgica nos gânglios da base.
Indicação: Eficazes no controle de tremor em pacientes mais jovens.
Efeitos adversos: Boca seca, constipação, confusão mental (especialmente em idosos).
f) Amantadina
Mecanismo: Potencializa a liberação de dopamina e tem efeitos anti-glutamatérgicos.
Indicação: Útil para tratar discinesias induzidas pela levodopa.
2. Tratamento cirúrgico
Indicado para pacientes com resposta insuficiente ao tratamento farmacológico ou com flutuações motoras graves.
a) Estimulação cerebral profunda (DBS)
O que é: Implante de eletrodos nos gânglios da base (geralmente no núcleo subtalâmico ou globo pálido interno).
Mecanismo: Estimula as regiões-alvo para reduzir sintomas motores.
Indicação: Pacientes com flutuações motoras severas ou tremor resistente aos medicamentos.
Benefícios: Reduz a necessidade de levodopa e melhora a qualidade de vida.
3. Terapias não farmacológicas
Essas abordagens complementam o tratamento para gerenciar sintomas motores e não motores.
a) Fisioterapia
Melhora a mobilidade, força muscular e equilíbrio.
Técnicas específicas ajudam a prevenir quedas e manter a funcionalidade.
b) Fonoaudiologia
Trata distúrbios de fala (hipofonia) e disfagia, comuns na DP.
c) Terapia ocupacional
Ajuda a adaptar as atividades do dia a dia, preservando a independência.
d) Exercícios físicos
Benefícios neuroprotetores e melhora da mobilidade.
Atividades como yoga, tai chi e dança ajudam no equilíbrio e na flexibilidade.
e) Suporte psicológico
Essencial para lidar com sintomas psiquiátricos (depressão, ansiedade) e o impacto emocional da doença.
4. Tratamento dos sintomas não motores
a) Distúrbios do sono: Melatonina ou clonazepam.
b) Depressão: Antidepressivos (ex.: inibidores seletivos da recaptação de serotonina).
c) Demência: Inibidores da acetilcolinesterase (ex.: rivastigmina).
d) Constipação: Dieta rica em fibras, hidratação e laxantes suaves.
e) Hipotensão ortostática: Fludrocortisona ou midodrina.
5. Terapias em pesquisa
Terapia gênica: Estudo de genes como GDNF para proteger neurônios.
Transplante de células-tronco: Tentativa de regenerar neurônios dopaminérgicos.
Novos medicamentos: Pesquisas sobre inibidores da agregação de α-sinucleína e moduladores imunológicos.
Importância da Nutrição
1. Nutrientes com efeito neuroprotetor ou modulador da dopamina
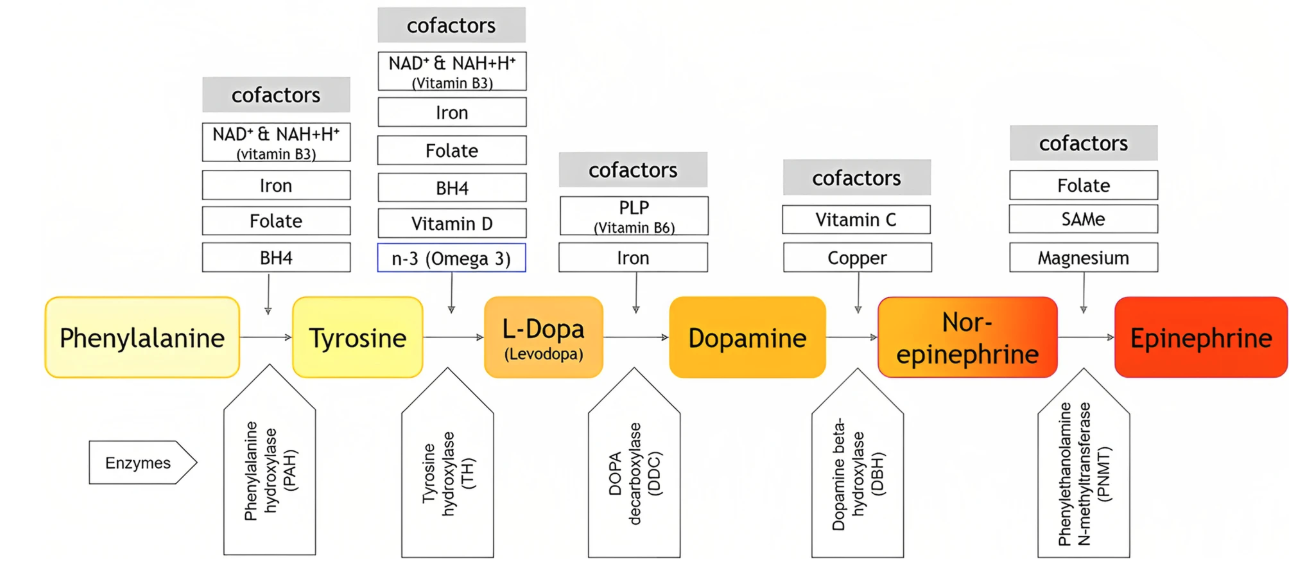
a) L-tirosina
O que é: Um aminoácido precursor da dopamina.
Efeito: Pode aumentar a síntese de dopamina, pois é convertido em L-DOPA no organismo.
Fontes alimentares: Carnes, peixes, ovos, laticínios, nozes, sementes e leguminosas.
Observação: Suplementação deve ser feita com cautela e acompanhamento médico.
Aminoácidos e co-fatores para síntese de dopamina (Mader, 2023)
b) Coenzima Q10
O que é: Um antioxidante natural essencial para a função mitocondrial.
Efeito: Reduz o estresse oxidativo, que é uma das causas de degeneração neuronal no Parkinson.
Fontes alimentares: Peixes gordurosos, carnes, espinafre, brócolis e nozes.
Estudos: Alguns estudos sugerem que a CoQ10 pode desacelerar a progressão da DP em estágios iniciais. Suplementação de 300 mg/dia por tempo prolongado (96 semanas) indicou melhoria dos sintomas com o passar do tempo (Yoritaka et al., 2015).
c) Vitamina D
Efeito: Pode modular a inflamação e proteger contra a degeneração neuronal.
Fontes alimentares: Peixes gordurosos, gema de ovo, cogumelos e alimentos fortificados.
Observação: Níveis adequados de vitamina D estão associados a menor risco de progressão da DP.
d) Ácidos graxos ômega-3
O que são: Gorduras poli-insaturadas com propriedades anti-inflamatórias e neuroprotetoras.
Efeito: Podem reduzir a inflamação e proteger os neurônios dopaminérgicos (Li, & Song, 2022).
Fontes alimentares: Peixes gordurosos (salmão, sardinha), linhaça, chia, nozes.
e) Curcumina (da cúrcuma)
Efeito: Antioxidante e anti-inflamatório potente; pode inibir a agregação de α-sinucleína e proteger os neurônios.
Fontes alimentares: Cúrcuma (açafrão-da-terra).
2. Nutrientes com propriedades antioxidantes
a) Vitamina C
Efeito: Neutraliza espécies reativas de oxigênio (ROS) e combate o estresse oxidativo.
Fontes alimentares: Laranja, limão, kiwi, morango, pimentão, brócolis.
b) Vitamina E
Efeito: Antioxidante que protege as membranas celulares contra danos.
Fontes alimentares: Amêndoas, sementes de girassol, espinafre, óleos vegetais (girassol, oliva).
c) Selênio
Efeito: Cofator de enzimas antioxidantes (glutationa peroxidase), que protegem contra o estresse oxidativo.
Fontes alimentares: Castanha-do-pará, nozes, frutos do mar, ovos.
d) Glutationa
O que é: Um antioxidante intracelular produzido pelo organismo.
Efeito: Ajuda a reduzir a toxicidade de α-sinucleína e protege os neurônios.
Fontes alimentares: Aspargos, abacate, espinafre e brócolis (estimulam a produção de glutationa).
Nutrientes que podem modular neurotransmissores
a) Cafeína
Efeito: Pode proteger os neurônios dopaminérgicos e melhorar os sintomas motores, segundo estudos.
Fontes alimentares: Café, chá preto, chá verde, chocolate amargo.
Observação: Consumo moderado é mais indicado.
b) Teanina
O que é: Um aminoácido encontrado no chá verde.
Efeito: Pode melhorar a cognição e reduzir o estresse, modulando a dopamina e outros neurotransmissores.
c) Resveratrol
O que é: Um polifenol com propriedades antioxidantes e anti-inflamatórias.
Fontes alimentares: Uvas roxas, vinho tinto, amendoim, cacau.
Efeito: Pode ajudar a prevenir a neurodegeneração.
4. Compostos para suporte mitocondrial e autofagia
a) Ácido alfa-lipóico
Efeito: Antioxidante e cofator enzimático que protege as mitocôndrias contra danos.
Fontes alimentares: Espinafre, brócolis, batata.
b) Polifenóis
Exemplos: Catequinas (chá verde), quercetina (maçã, cebola), antocianinas (frutas vermelhas).
Efeito: Estimulam a autofagia, reduzindo o acúmulo de α-sinucleína.
b) Creatina
Composto natural encontrado nos músculos e no cérebro, que tem como função principal ajudar no fornecimento de energia para os músculos durante atividades intensas. Ela é comumente utilizada como suplemento para melhorar o desempenho atlético e aumentar a massa muscular.
Efeito: Pode ter um efeito neuroprotetor e pode ajudar a proteger os neurônios, especialmente em doenças neurodegenerativas, pois reduz o estresse oxidativo, protege contra a disfunção mitocondrial, melhorando a função motora e retardando o declínio da função física.
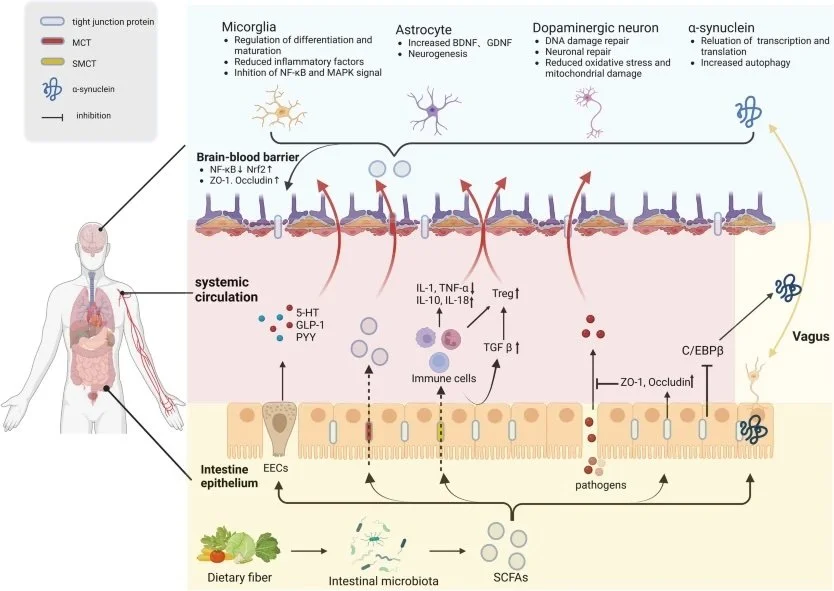
5. Probióticos
Efeito: Melhoram a saúde intestinal, que está intimamente relacionada ao eixo intestino-cérebro.
Observação: Estudos sugerem que a disbiose intestinal pode piorar os sintomas da DP. Além disso, a perda de células nervosas pode acontecer também no intestino, afetando os movimentos intestinais.
Fontes alimentares: Iogurte, kefir, kombucha, alimentos fermentados. Existem também suplementos contendo bactérias probióticas, mas precisa ser muito criteriosa pois o uso inadequado de bactérias pode agravar os sintomas do Parkinson (expliquei neste outro texto o caso da Akkermansia. Recomenda-se a avaliação da microbiota intestinal para escolha das melhores alternativas.
5. Fibras prebióticas
Efeito: Melhoram a saúde intestinal, são usadas como fonte de energia, fermentadas para produção de ácidos graxos de cadeia curto (SCFAs) com vários efeitos benéficos, incluindo a regulação imune e redução da neuroinflamação.
Observação: Estudos sugerem que a disbiose intestinal pode piorar os sintomas da DP. Além disso, a perda de células nervosas pode acontecer também no intestino, afetando os movimentos intestinais.
Fontes alimentares: bananas verdes, framboesas, morango, alho, cebola, alho-poró, aspargos, couve-de-bruxelas, grão de bico, lentilhas, aveia, batata doce, inhame, chia, linhaça, psyllium.
Fibras podem ser usadas principalmente para pacientes constipados ou com dificuldade de mastigação ou deglutição de alimentos de origem vegetal. Lembrando que atividade física, boa hidratação, rotina intestinal (horários regulares para ir ao banheiro), massagens abdominais também são estratégias importantes no caso de prisão de ventre.
Cuidados
Alimentação equilibrada: Uma dieta rica em frutas, vegetais, grãos integrais e gorduras saudáveis fornece antioxidantes e nutrientes essenciais.
Interação com medicamentos: Alguns nutrientes ou suplementos podem interagir com medicamentos para Parkinson, como a levodopa (ex.: excesso de proteínas na dieta pode reduzir a eficácia da levodopa).
Recomenda-se consumir proteínas à noite para evitar interferência na absorção da levodopa durante o dia.
Supervisão nutricional: Antes de iniciar qualquer suplemento ou mudança na dieta, é essencial consultar um nutricionista especialista na áreas.
O tratamento da doença de Parkinson combina medicamentos, intervenções cirúrgicas e terapias complementares para oferecer um manejo mais eficaz dos sintomas, com o objetivo de melhorar a qualidade de vida dos pacientes.
Marque aqui sua consulta de nutrição online
A evolução constante das pesquisas traz esperança para tratamentos que possam retardar ou prevenir a progressão da doença. Aprenda mais sobre o cérebro em https://t21.video