O artigo "Insights into the constellating drivers of satiety impacting dietary patterns and lifestyle", publicado na revista Frontiers in Nutrition em setembro de 2022, oferece uma análise abrangente dos múltiplos fatores que influenciam a saciedade e, consequentemente, os padrões alimentares e o estilo de vida.
🧠 Fatores Internos que Influenciam a Saciedade
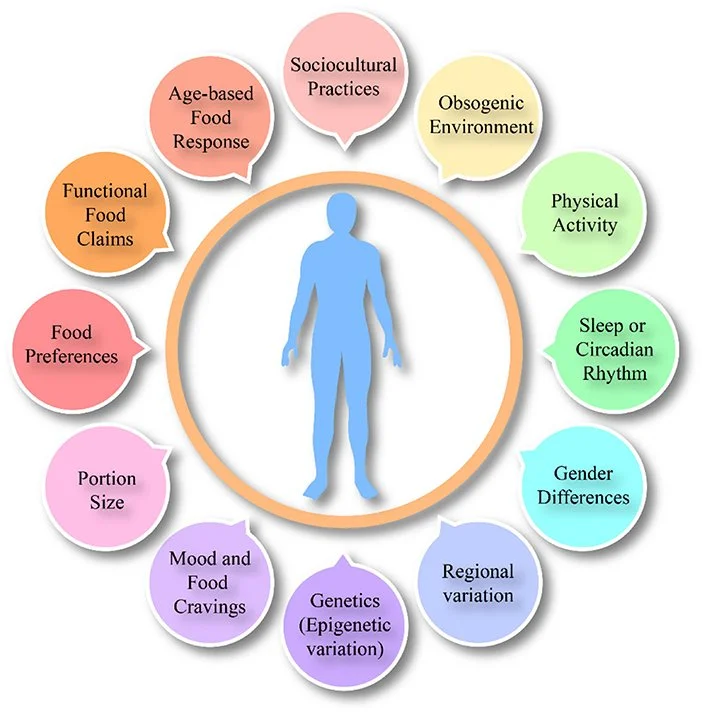
A saciedade é regulada por uma complexa rede de sinais fisiológicos e psicológicos. Fatores internos como genética, idade, sexo, composição corporal, metabolismo, sinais gastrointestinais, microbiota intestinal e ritmos circadianos desempenham papéis cruciais na determinação da sensação de saciedade. Por exemplo, a taxa de esvaziamento gástrico e os hormônios intestinais influenciam diretamente o tempo que uma pessoa permanece saciada após uma refeição.
Mecanismos Fisiológicos da Saciedade
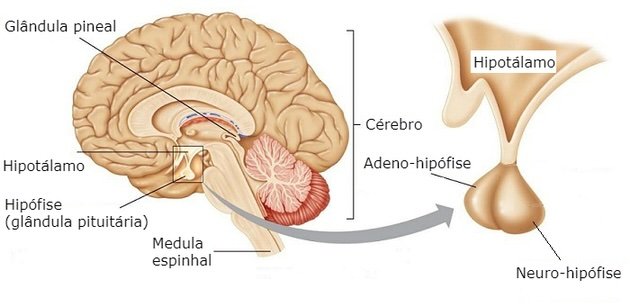
A saciedade é uma resposta homeostática complexa, cujo objetivo central é modular a ingestão energética de acordo com as necessidades do corpo. Essa regulação é mediada por sistemas neuroendócrinos e digestivos que sinalizam ao cérebro o status energético atual.
Sinais gastrointestinais: Hormônios como a grelina (que estimula o apetite) e a leptina e peptídeo YY (que promovem a saciedade) têm papéis cruciais. A sensibilidade a esses hormônios pode variar individualmente, impactando padrões alimentares.
Esvaziamento gástrico: Alimentos ricos em fibra e proteína tendem a retardar o esvaziamento do estômago, prolongando a sensação de saciedade.
Metabolismo de substratos: O tipo de macronutriente ingerido influencia o quociente respiratório (QR), que, por sua vez, afeta a percepção de saciedade. Dietas ricas em gordura, por exemplo, têm um impacto menor sobre o QR comparado às dietas ricas em carboidratos.
Fatores Genéticos e Neurocomportamentais
A variabilidade genética pode influenciar o modo como cada indivíduo responde aos estímulos de saciedade:
Sensibilidade oral: A densidade e responsividade dos receptores gustativos modulam a experiência sensorial da alimentação, o que afeta tanto o prazer alimentar quanto a saciedade pós-refeição.
Traços de personalidade: Pessoas com altos níveis de neuroticismo ou baixos níveis de conscienciosidade tendem a comer de forma mais impulsiva ou emocional, suprimindo os sinais fisiológicos de saciedade.
Vulnerabilidade psicológica: Fatores como ansiedade e estresse crônico elevam o cortisol, que por sua vez reduz a percepção de saciedade e aumenta a ingestão calórica, especialmente de alimentos hipercalóricos.
Fatores Externos e Comportamentais
Além dos fatores internos, elementos externos como ambiente alimentar, comportamento alimentar, padrões de sono e cronotipo (preferência por atividades matutinas ou noturnas) também afetam a saciedade. Estudos indicam que indivíduos com cronotipo noturno tendem a ter padrões alimentares menos saudáveis e maior propensão ao consumo de alimentos energéticos no período noturno, o que pode impactar negativamente a regulação da saciedade.
Ambiente Alimentar e Estilo de Vida
A saciedade também é moldada pelo contexto social e ambiental:
Ambiente obesogênico: A exposição constante a alimentos ultraprocessados, publicidade e disponibilidade alimentar a qualquer hora compromete os mecanismos naturais de saciedade.
Comportamento alimentar: Comer com distração (por exemplo, assistindo TV) reduz a consciência do ato de comer, dificultando o reconhecimento da plenitude.
Padrões de sono e cronotipo: Dormir pouco ou ter cronotipo vespertino está associado a alterações hormonais que afetam negativamente os sinais de saciedade e favorecem o consumo de alimentos no período noturno.
Interação entre Fatores e Implicações para a Saúde
O artigo destaca que a saciedade não é determinada por um único fator isolado, mas sim pela interação entre múltiplos elementos fisiológicos, psicológicos e comportamentais. Por exemplo, a combinação de fatores metabólicos (como o quociente respiratório e o tipo de substrato energético utilizado), sensibilidade oral, traços de personalidade (como agradabilidade, conscienciosidade e neuroticismo) e comportamentos alimentares (como comer emocional ou externo) são determinantes importantes para explicar as respostas individuais de saciedade.
Compreender essas interações é essencial para desenvolver estratégias personalizadas de intervenção nutricional e promover escolhas alimentares mais saudáveis, contribuindo para a prevenção de distúrbios alimentares e doenças relacionadas à alimentação.
Existe plasticidade, ou seja, a possibilidade de modulação desse sistema ao longo do tempo:
Treinamento comportamental: Intervenções de “mindful eating” ou atenção plena ao comer têm mostrado eficácia em restaurar a percepção de saciedade.
Intervenções nutricionais personalizadas: Dietas que respeitam a individualidade metabólica, psicológica e sensorial são mais eficazes a longo prazo do que abordagens padronizadas.
Papel da microbiota intestinal: Novas evidências mostram que certos perfis de microbiota estão associados a maior produção de metabólitos como SCFAs (ácidos graxos de cadeia curta), que aumentam a liberação de hormônios de saciedade.