O artigo “The Role of Epigenetics in Hypothalamic Energy Balance Control: Implications for Obesity” revisa como mecanismos epigenéticos — como metilação do DNA, modificações de histonas e regulação por RNAs não codificantes — influenciam o desenvolvimento e a função do hipotálamo, órgão central no controle do balanço energético, fome, saciedade e gasto calórico. Essas alterações podem programar uma predisposição à obesidade, especialmente quando ocorrem em períodos críticos como gestação, infância ou puberdade.
A obesidade é uma condição multifatorial, influenciada por uma interação complexa entre fatores genéticos e ambientais. Em casos de obesidade severa, a influência genética pode ser muito grande, com estimativas de herdabilidade variando entre 60 a 80%.
Alterações nos genes LEP, LEPR, POMC e MC4R afetam diretamente a regulação do apetite pelo hipotálamo e estão associadas a formas monogênicas de obesidade.
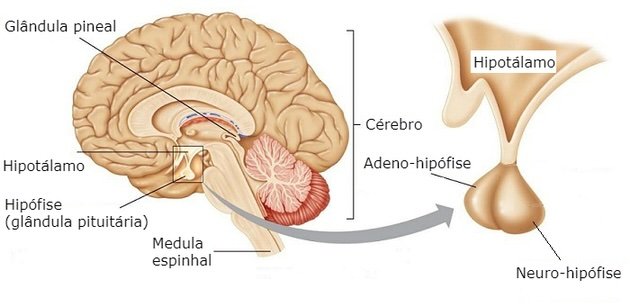
O hipotálamo é uma região do cérebro fundamental na regulação de diversas funções do corpo, incluindo o apetite e o controle da fome. Ele atua como um centro integrador que recebe sinais do corpo sobre o estado energético e, com base nisso, regula o comportamento alimentar.
Hipotálamo e Controle do Balanço Energético
O hipotálamo integra sinais periféricos (leptina, insulina, grelina) com sinais centrais para:
Regular apetite (via núcleos arcuato, PVN, LHA)
Controlar gasto energético
Manter homeostase glicêmica e lipídica
Essa regulação depende da correta expressão de genes específicos nas vias anorexígenas (POMC, CART) e orexígenas (NPY, AgRP).
Mecanismos Epigenéticos Principais
O termo epigenética foi usado pela primeira vez em 1942 pelo cientista Conrad Waddington. Ele o definiu como a área da biologia que estuda como os genes interagem com outras substâncias do corpo para formar as características de um organismo (o fenótipo).
Mais tarde, essa definição foi atualizada. Hoje, epigenética se refere às mudanças na forma como os genes são ativados ou desativados, que podem ser herdadas, sem que haja alteração na sequência do DNA. Essas mudanças podem ser causadas por fatores ambientais (como alimentação, estresse ou poluição) ou por experiências vividas nos primeiros anos de vida.
Imagine que o DNA é como um livro de receitas que contém todas as instruções (genes) para fazer o corpo funcionar. Cada página do livro representa um gene.
Agora, a epigenética funciona como marcadores feitos com post-its ou canetas nesse livro. Esses marcadores podem destacar, riscar ou dobrar certas páginas. Isso significa que algumas receitas (genes) podem ser ligadas (ativadas) ou desligadas (silenciadas) — sem alterar o conteúdo original do livro.
Esses marcadores podem ser colocados ou removidos ao longo da vida por causa de coisas como a alimentação, o estresse, a poluição, ou até o carinho que alguém recebeu na infância. E, em alguns casos, esses marcadores podem até ser passados para os filhos, mesmo que o DNA (o livro) continue exatamente o mesmo.
Atualmente temos bem descritos na literatura científica 3 mecanismos epigenéticos, ou seja, 3 mecanismos que são capazes de alterar a expressão de nossos genes sem alterar a sequência das bases:
🧬 Metilação do DNA
Adição de grupos metil à citosina (CpG) → geralmente reduz expressão gênica.
Pode silenciar genes importantes no controle do apetite (ex: POMC) ou alterar resposta à leptina/insulina.
🧬 Modificações de histonas
Alteram a estrutura da cromatina (mais aberta = mais expressão).
Acetilação (via HATs) favorece transcrição; desacetilação (via HDACs) reprime.
Histonas no núcleo arcuato modulam genes-chave do metabolismo energético.
🧬 miRNAs e outros RNAs não codificantes
Pequenas moléculas de RNA que reprimem a tradução de mRNAs.
Ex: miR-200a, miR-103/107 modulam sensibilidade à leptina e expressão de NPY/AgRP.
Janela Crítica: Programação Epigenética Precoce
Ambiente intrauterino e pós-natal pode “programar” epigeneticamente o hipotálamo, com consequências duradouras:
Desnutrição ou obesidade materna → Uma alimentação pobre durante a gravidez pode causar alterações epigenéticas no feto, modificando genes que controlam o apetite, o armazenamento de gordura e o metabolismo. Isso pode aumentar o risco de obesidade e diabetes tipo 2 na vida adulta. Alterações significativas de peso podem mudar o padrão de metilação de genes como POMC, leptina e seus receptores.
Exposição a dietas ricas em gordura e açúcar durante o desenvolvimento → altera epigenoma hipotálamo → aumento de ingestão calórica no adulto.
Efeitos podem ser transgeracionais, via gametas.
Epigenética e Disfunção Hipotalâmica na Obesidade
O acúmulo de mudanças epigenéticas ao longo do tempo pode alterar as trajetórias de saúde de um indivíduo de maneira positiva ou negativo. Os nutrientes são considerados reguladores epigenéticos que interagem com o epigenoma e alteram o funcionamento dos nossos genes ao longo da vida.
Indivíduos obesos apresentam alterações epigenéticas em genes envolvidos na sinalização da leptina e insulina.
Alterações em genes reguladores da inflamação e do sistema dopaminérgico também contribuem para maior apetite e menor saciedade.
Há neurogênese hipotalâmica alterada, comprometendo circuitos de controle de energia.
Implicações Terapêuticas
Intervenções precoces (alimentação materna, aleitamento, ambiente) podem prevenir alterações epigenéticas deletérias.
Drogas que modulam epigenética (ex: inibidores de HDACs, nutrientes como folato, B12 e colina) têm potencial de reprogramar vias metabólicas.
Estratégias como nutrição personalizada, suplementação precoce e modulação de microbiota podem atuar na reversão de marcas epigenéticas associadas à obesidade.