A esclerose lateral amiotrófica (ELA) envolve a degeneração dos neurônios motores e sintomas debilitantes e possivelmente fatais. A pandemia da COVID-19 afetou diretamente a qualidade de vida desse grupo, e a infecção pelo SARS-CoV-2 acelerou o processo neuroinflamatório dos pacientes. Além disso, estudos indicam que a infecção pode ter levado ao desenvolvimento da patologia em mais pessoas (Simões et al., 2024).
COVID como gatilho para ELA (Simões et al., 2024)
O artigo "Fibrose como uma Característica Comum nos Tecidos da Esclerose Lateral Amiotrófica (ELA)" destaca o papel emergente da fibrose (acúmulo excessivo de tecido conjuntivo fibroso) na Esclerose Lateral Amiotrófica (ELA), uma doença neurodegenerativa caracterizada pela degeneração dos neurônios motores. A pesquisa identifica a fibrose como uma característica patológica presente em diversos tecidos afetados pela ELA, expandindo a compreensão dos mecanismos da doença. Aqui estão os aspectos mais importantes do artigo:
1. Identificação da Fibrose na ELA
O estudo fornece evidências claras de que a fibrose é uma característica comum em vários tecidos de pacientes com ELA, incluindo a medula espinhal, os músculos esqueléticos e os pulmões.
Isso desafia a visão tradicional da ELA como sendo apenas uma doença neurodegenerativa, ao destacar o envolvimento da modelação da matriz extracelular (MEC) e processos fibróticos na progressão da doença.
2. Fibrose no Sistema Nervoso Central (SNC)
A pesquisa mostra mudanças fibróticas significativas na medula espinhal de pacientes com ELA, onde ocorre a degeneração dos neurônios motores. Essas mudanças incluem um aumento na deposição de colágeno e nos marcadores de fibrose no tecido da medula espinhal, o que pode contribuir para a progressão da degeneração dos neurônios motores, criando um ambiente tóxico para os neurônios. A fibrose no SNC pode prejudicar a comunicação celular normal e o reparo dos axônios, agravando ainda mais a neurodegeneração.
3. Fibrose nos Músculos Esqueléticos
Os músculos esqueléticos de pacientes com ELA apresentam cicatrizes fibróticas e acúmulo excessivo de colágeno, o que pode ser uma resposta à desnervação (perda da inervação devido à morte dos neurônios motores).
Essa fibrose no tecido muscular pode agravar a atrofia muscular e a fraqueza, que são sintomas centrais da ELA, limitando ainda mais a mobilidade e a qualidade de vida dos pacientes.
4. Fibrose em Outros Órgãos
O estudo também nota fibrose em órgãos além do sistema nervoso e músculos, como os pulmões, sugerindo que a ELA afeta múltiplos sistemas e que a fibrose pode ser uma resposta comum em diferentes tecidos.
Isso indica que a ELA tem efeitos sistêmicos, e as alterações fibróticas podem contribuir para a insuficiência respiratória, uma das causas comuns de morte em pacientes com ELA.
5. Mecanismos Moleculares que Conduzem à Fibrose na ELA
O artigo explora possíveis vias moleculares que levam à fibrose na ELA, incluindo:
- A sinalização da TGF-β (Fator de Crescimento Transformador-Beta), uma via chave que promove processos fibróticos, está aumentada nos tecidos com ELA.
- Metaloproteinases de Matriz (MMPs), que regulam a remodelação da matriz extracelular, estão desreguladas, contribuindo para o acúmulo excessivo de MEC.
6. Implicações Terapêuticas Potenciais
Ao identificar a fibrose como parte da patologia da ELA, o estudo abre novas vias terapêuticas. O alvo de vias relacionadas à fibrose (como inibidores da TGF-β ou agentes anti-fibróticos) pode retardar a progressão da doença ou aliviar os sintomas, reduzindo a cicatrização tecidual.
Tratamentos anti-fibróticos, comumente usados em doenças como fibrose pulmonar, podem ser reaproveitados para a ELA, protegendo os tecidos dos danos fibróticos.
O artigo discute a conexão entre inflamação crônica nos tecidos com ELA e o desenvolvimento de fibrose. Processos inflamatórios provavelmente desempenham um papel significativo na iniciação e manutenção das mudanças fibróticas, especialmente pela ativação dos fibroblastos e dos componentes da matriz extra celular.
Recomendações nutricionais
Baseando-se nos achados do artigo sobre a fibrose como uma característica relevante na Esclerose Lateral Amiotrófica (ELA), é possível elaborar estratégias nutricionais que auxiliem no controle da fibrose, abordando a inflamação crônica, remodelação da matriz extracelular (MEC) e o estresse oxidativo. Aqui estão as principais recomendações nutricionais:
1. Reduzir a Ativação da Fibrose (via TGF-β e MEC)
O controle da sinalização do TGF-β, que desempenha papel central na fibrose, pode ser apoiado por nutrientes e compostos bioativos.
Curcumina: Inibe a sinalização do TGF-β e tem propriedades anti-fibróticas e anti-inflamatórias. Adicionar açafrão da terra e pimenta-do-reino (pimenta preta) a todas as refeições ou suplementar em cápsulas.
Resveratrol: Atua como modulador de TGF-β e tem potencial para reduzir o acúmulo de colágeno. Insira na dieta fontes como uvas vermelhas, amendoim e mirtilos ou faça a suplementação de Trans-resveratrol.
Chá Verde (EGCG):
Inibe a fibrogênese e a deposição de MEC em estudos pré-clínicos. Consuma chá verde ou suplementos de EGCG.
2. Suporte Anti-inflamatório
A inflamação crônica contribui significativamente para a fibrose. Alimentos anti-inflamatórios podem ajudar a modular processos fibróticos.
Ácidos Graxos Ômega-3: Reduzem a inflamação crônica e modulam fibroblastos ativados. Insira n a dieta peixes gordurosos (salmão, sardinha, atum), chia, linhaça e nozes e faça a suplementação de ômega-3.
Vitamina D: Modula a resposta imune e pode ajudar a reduzir processos fibróticos. Avalie seus níveis de vitamina D no plasma e faça a suplementação para mantê-la por volta de 60 ng/mL.
Polifenóis: Presentes em frutas vermelhas, romãs e vegetais coloridos e suplementos com propriedades anti-inflamatórias e anti-fibróticas.
3. Reduzir o Estresse Oxidativo
O estresse oxidativo agrava a degeneração neuronal e estimula a fibrose. Antioxidantes na dieta são essenciais.
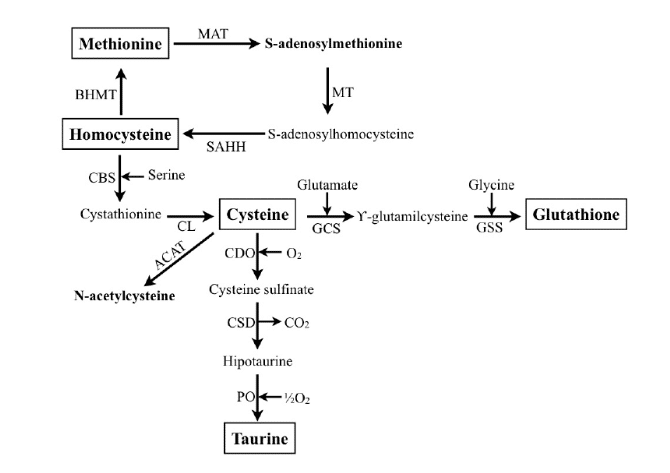
Glutationa e Precursores: Estimulam a defesa antioxidante no organismo. Fontes: abacate, aspargos, espinafre e suplementação com N-acetilcisteína (NAC).
Vitaminas C e E: Neutralizam radicais livres e protegem os tecidos contra o dano oxidativo. Fontes: frutas cítricas, castanhas, sementes e óleos vegetais.
Selênio: Cofator essencial para enzimas antioxidantes. Fontes: castanha-do-pará, frutos do mar, ovos.
Coenzima Q10: Melhora a função mitocondrial e pode proteger o tecido pulmonar. Prefiro a suplementação na forma ativa (ubiquinol).
4. Modulação da Microbiota Intestinal
A saúde intestinal influencia processos inflamatórios sistêmicos e pode impactar a fibrose.
Probióticos e Prebióticos: Melhoram a barreira intestinal e reduzem marcadores inflamatórios. Fontes: iogurte natural, kefir, kombucha, fibras alimentares (aveia, banana verde).
Fibra Solúvel: Promove produção de ácidos graxos de cadeia curta (butirato), com propriedades anti-inflamatórias. Fontes: aveia, leguminosas, maçã, cenoura, psyllium.
5. Controle do Acúmulo de Colágeno
Regulação da remodelação da matriz extracelular é crucial na ELA.
Quercetina: Inibe a atividade de metaloproteinases desreguladas e previne o excesso de MEC. Fontes: maçãs, cebolas, brócolis, suplementos.
Silimarina (Cardo-mariano): Estimula regeneração tecidual e reduz fibrose em modelos experimentais. Pode ser manipulada.
Vitamina K2: Pode ajudar a regular a mineralização e reduzir a deposição excessiva de MEC. Fontes: queijos fermentados, natto (soja fermentada).
6. Manutenção da Massa Muscular e Mobilidade
Como a fibrose nos músculos agrava a atrofia muscular, é essencial preservar a função muscular.
Proteínas de Alta Qualidade: Estimulam a regeneração muscular.
Fontes: ovos, peixes, carnes magras, proteínas vegetais (leguminosas), whey protein.
Magnésio: Essencial para função muscular e neuromuscular. Fontes: vegetais verdes escuros, nozes, sementes. Gosto de suplementar o magtein manipulado.
Essas estratégias nutricionais devem ser adaptadas para cada paciente, considerando intolerâncias alimentares, estado nutricional e progressão da doença, em colaboração com uma equipe de saúde multidisciplinar. Precisa de ajuda e individualização? Marque aqui sua consulta de nutrição online.