O sistema imunológico consiste em um conjunto de barreiras, moléculas e células que se organizam em tecidos e órgãos, funcionando em estreita interação para gerar uma resposta protetora contra invasores. Fazem parte deste sistema as barreiras físicas (pele, intestino, pulmão, barreira hemato-encefálica), as respostas imune inata, inflamatória, adaptativa (incluindo imunidade humoral e mediada por células). Cada uma destas resposta requer uma série de nutrientes para que tudo corra bem. Se a pessoa está desnutrida, a imunidade será alterada.
A dieta monótona afeta a imunidade de qualquer pessoa (Gombart, Pierre, & Maggini, 2020).
Papel do sistema imune
O sistema imune inato primeiro reconhece padrões moleculares associados a patógenos e ativa células não especializadas (como neutrófilos e células natural killers - NK) para produzir citocinas pró-inflamatórias e reguladoras. Estas substâncias causam vasodilatação, aumento da permeabilidade vascular e maior chegada de substâncias de defesa ao “local problema”.
Com o passar do tempo o corpo vai aprendendo o que faz bem e o que não faz e memorizando como responder de forma mais eficiente a cada ataque. Os linfócitos começam a se diferenciar e a produzir anticorpos, que neutralizam toxinas, impedem a movimentação e destróem patógenos. O problema é que quanto mais uma pessoa está inflamada mais os efeitos adversos da ativação excessiva do sistema imune manifestam-se.
Sintomas comuns do exagero na produção de citocinas incluem: febre, calafrios, cansaço, náuseas, diarreia, queda da pressão sanguínea, tosse, dores, tontura, dificuldade para engolir. Estas citocinas também podem atravessar a barreira hematoencefálica e gerar dores de cabeça, confusão mental e mudanças comportamentais.
Resposta imune no Transtorno do Espectro do Autismo (TEA)
A resposta imune adaptativa desempenha um papel importante no desenvolvimento do autismo. As proteínas do Complexo Principal de Histocompatibilidade (MHC) estão envolvidas nas respostas imunes adaptativa e inata.
Os alelos A2 do antígeno leucocitário humano (HLA), receptor de morte (DR) 4 e DR11 estão associados a uma resposta linfocitária diminuída e estão envolvidos em uma grande suscetibilidade ao TEA. Dentro da região HLA classe III, existe um alelo nulo do complemento C4B, resultante de duplicações de C4A, que confere um risco relativo de 4,3 para o desenvolvimento de TEA.
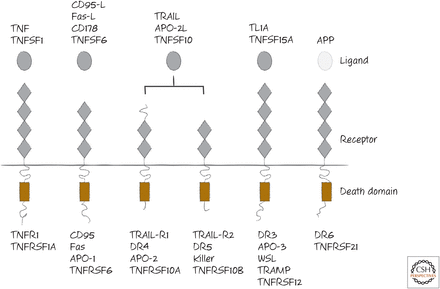
Recetores de morte (death receptors) e proteínas que os ativam. Estes ligantes são membros da família do fator de necrose tumoral (TNF) e os receptores são da família de rceptores de TNF (Green, 2022).
Pesquisas demonstraram que há uma regulação positiva de genes envolvidos na ativação imune inata, particularmente na via de células Natural Killer (NK), em indivíduos com TEA. As células NK desempenham um papel importante na defesa imunológica, e alterações na sua atividade foram observadas em crianças com TEA, indicando uma possível influência da imunidade inata na manifestação clínica do transtorno.
Papel da Proteína MHC-I
A proteína MHC-I, que está localizada nas sinapses e regula a transmissão sináptica no cérebro, tem sido associada ao TEA. O desequilíbrio nos níveis de MHC-I nos neurônios pode afetar a conectividade sináptica, levando a alterações no desenvolvimento cerebral e contribuindo para os sintomas típicos do transtorno.
Polimorfismos e Mutações no MHC-I
Haplótipos específicos do MHC-I e mutações genéticas associadas ao MHC-I foram implicados no desenvolvimento do TEA, sugerindo que a imunidade periférica pode interagir com o sistema nervoso central, influenciando a conectividade neural e a função cerebral.
Citocinas e Respostas Imunes
A regulação de citocinas, que são proteínas que mediam as respostas imunes, também está alterada em indivíduos com TEA. Em particular, o aumento de citocinas pró-inflamatórias, como IL-1, IL-6 e IL-17, foi frequentemente observado, e essas alterações podem estar relacionadas à gravidade do transtorno, afetando tanto o comportamento quanto o desenvolvimento social.
Células Th1, Th2 e Th17 no TEA
A desregulação de células T auxiliares (Th1, Th2, Th17 e Tregs) tem sido uma característica comum no TEA. Estudos indicam que a desregulação dos fatores de transcrição relacionados a essas células pode contribuir para o desequilíbrio imunológico observado no transtorno, impactando diretamente o comportamento e a função neural.
Linfócitos T e Comportamento Aberrante
Em muitos indivíduos com TEA, observa-se um desequilíbrio nos linfócitos T, com uma proporção anormal de células T auxiliares-supressoras e um déficit de células T reguladoras. Esse desequilíbrio pode resultar na liberação desregulada de citocinas, exacerbando os sintomas comportamentais, como irritabilidade e hiperatividade.
Citocinas e Interações Cérebro-Periféricas
As interações entre o sistema imune periférico e o cérebro são fundamentais para o desenvolvimento do TEA. Citocinas derivadas de linfócitos, como IL-17A e IL-22, afetam diretamente a função cerebral e o comportamento. Além disso, as alterações no microbioma materno e intestinal têm sido identificadas como moduladores das respostas imunes e podem influenciar as respostas inflamatórias no cérebro, impactando o neurodesenvolvimento.
Autoimunidade e o TEA
A relação entre autoimunidade e o TEA é um campo de estudo crescente. Há evidências de que autoanticorpos maternos, como aqueles contra o receptor de folato (FRA), podem alterar o desenvolvimento fetal e aumentar o risco de TEA. A exposição ao ambiente imunológico materno pode influenciar o desenvolvimento do sistema nervoso central da criança, promovendo anormalidades no comportamento.
Autoanticorpos e Suscetibilidade ao TEA
Pesquisas indicam que a presença de autoanticorpos, como os dirigidos contra proteínas neuronais como o gangliosídeo M1 e a proteína glial fibrilar ácida, está associada a alterações no tecido cerebral de indivíduos com TEA. Essa ativação autoimune pode estar ligada a respostas inflamatórias e disfunções neurológicas observadas no transtorno.
Imunidade Materna e o Risco de TEA
Estudos sobre a imunidade materna durante a gestação sugerem que anticorpos específicos, como os autoanticorpos contra o receptor de folato, podem interferir no transporte de nutrientes essenciais, como o folato, para o feto. Isso pode afetar diretamente o desenvolvimento cerebral e aumentar o risco de transtornos do neurodesenvolvimento, incluindo o TEA.
Imunidade Inata no TEA: O Papel das Células Natural Killer (NK)
As células NK desempenham um papel crucial na defesa do organismo, e em crianças com TEA, foi observada uma alteração na atividade dessas células. A regulação positiva de citocinas, como IL-15 e IL-12, em crianças com TEA também foi reportada, sugerindo uma possível contribuição da imunidade inata para os sintomas do transtorno.
Microglia e Conectividade Cerebral no TEA
A microglia, uma célula do sistema imunológico central, está envolvida na resposta inflamatória no cérebro e tem sido associada a anomalias na conectividade cerebral em indivíduos com TEA. A ativação excessiva da microglia pode afetar a neurogênese e a sinaptogênese, levando a alterações no comportamento e na função cognitiva.
Vários estudos sugerem que fatores imunológicos, como infecções maternas durante a gestação, podem desempenhar um papel crucial no desenvolvimento de distúrbios do espectro autista (TEA).
1. Infecção Materna e a Desregulação Imunológica Pré-Natal
Pesquisas sugerem que infecções maternas durante a gravidez podem alterar a resposta imunológica e afetar o desenvolvimento fetal. O modelo MIA (Maternal Immune Activation) mostra que desafios infecciosos, como a gripe e o herpes, podem induzir uma resposta imune exacerbada, afetando a produção de IGF-1 (fator de crescimento semelhante à insulina) no recém-nascido. A redução deste fator pode prejudicar a mielinização neuronal, um processo essencial para a função cerebral adequada, o que pode, por sua vez, contribuir para o desenvolvimento do autismo.
2. Citocinas e seu Impacto no Fenótipo Clínico do Autismo
Estudos indicam que as citocinas desempenham um papel fundamental na gravidade do TEA. A presença de altos níveis de citocinas inflamatórias como IL-1β, IL-6, TNF-α, e IL-12p70 está associada a sintomas mais graves, como dificuldades de comunicação social e comportamento estereotipado. A disfunção na regulação de citocinas, como IL-10 e TGF-β1, também está correlacionada com distúrbios do comportamento e dificuldades cognitivas. A regulação dessas moléculas pode influenciar diretamente a conectividade neural e as funções cognitivas no TEA.
3. Desregulação Imunológica e Comorbidades Associadas ao Autismo
Além dos aspectos neurológicos, as crianças com TEA frequentemente apresentam comorbidades imunomediadas. Entre as mais comuns estão:
Alergias e Asma: Crianças com autismo têm uma taxa mais alta de alergias, incluindo rinite alérgica e asma, que podem exacerbar os sintomas comportamentais do TEA.
Distúrbios Gastrointestinais (GI): Aproximadamente 50% das crianças com autismo sofrem de disfunções gastrointestinais, caracterizadas por inflamação intestinal, aumento da permeabilidade intestinal e uma produção exacerbada de citocinas inflamatórias.
Epilepsia e Distúrbios do Sono: A epilepsia é uma condição comórbida frequente no autismo, e a regulação de citocinas como IL-12 p40 e IL-6 pode ser um marcador de distúrbios epilépticos em pacientes com TEA.
4. O Papel do Microbioma Intestinal e o Eixo Intestino-Cérebro
A relação entre o microbioma intestinal e o cérebro, conhecida como eixo microbiota-intestino-cérebro, também está sendo explorada como um fator potencial no desenvolvimento do TEA. Alterações na composição da microbiota e nos metabólitos bacterianos podem influenciar a função cerebral e comportamentos, particularmente devido à sua capacidade de afetar a barreira hematoencefálica e a resposta imunológica.
5. Obesidade materna
A obesidade materna tem sido associada ao desenvolvimento de diversos distúrbios neuropsiquiátricos, incluindo o Transtorno do Espectro Autista (TEA). Durante a gravidez, o sistema imunológico da mãe desempenha um papel crucial, protegendo contra patógenos externos e prevenindo a rejeição do feto. Quando o blastocisto se implanta no útero, ocorre uma reação inflamatória que é regulada positivamente por citocinas como IL-6 e TNF, que são fundamentais para a reparação do epitélio uterino e para a progressão do parto. No entanto, a obesidade materna leva a uma inflamação crônica de baixo grau, que aumenta durante a gestação e pode predispor o feto ao desenvolvimento de distúrbios neuropsiquiátricos.
Embora o vínculo entre a obesidade materna e a patologia do autismo não seja completamente compreendido, pesquisas indicam que a obesidade pode afetar o neurodesenvolvimento fetal, alterando o comportamento microglial e provocando modificações epigenéticas no cérebro. A meta-inflamação gerada pela obesidade, caracterizada pela presença de inflamação de baixo grau nos tecidos adiposos, pode prejudicar o desenvolvimento do cérebro fetal. A placenta também desempenha um papel importante nesse processo, já que produz citocinas que podem ser transmitidas ao feto e afetar o desenvolvimento neuronal.
Além disso, hormônios derivados do tecido adiposo, como a leptina, têm sido associados à ativação de células microgliais e à produção de citocinas inflamatórias, o que pode agravar a neuropatologia em distúrbios neuropsiquiátricos, incluindo o TEA. Os ácidos graxos saturados e poli-insaturados (SFAs/PUFAs) também desempenham um papel importante nesse processo, pois foram identificados como moduladores imunológicos que influenciam a inflamação no sistema nervoso central e a ativação de macrófagos, podendo contribuir para alterações no desenvolvimento neuronal e na função cerebral.
Estudos em modelos animais demonstraram que uma dieta materna rica em gorduras pode provocar alterações comportamentais nas mães e impactos negativos no cuidado materno, além de reduzir a produção placentária de fatores de crescimento essenciais, como o IGF-1, que afeta a transferência de nutrientes para o feto. Esses fatores são cruciais para o desenvolvimento saudável da prole, e qualquer desequilíbrio durante a gestação pode aumentar o risco de distúrbios neuropsiquiátricos.
6. Desregulação imune e risco de doenças neurodegenerativas
Distúrbios neuropsiquiátricos e neurodegenerativos, como o TEA e a Doença de Parkinson (DP), compartilham mecanismos imunopatológicos comuns, apesar de suas diferenças clínicas. Ambos estão relacionados à disfunção cerebral e à ativação da resposta imune, em especial das células gliais, que desempenham um papel crucial na inflamação do cérebro. Essas células, como a microglia e os astrócitos, produzem citocinas e outras moléculas inflamatórias que recrutam células imunes locais e periféricas para os tecidos afetados, promovendo a neuroinflamação.
Em relação ao TEA, que é caracterizado por deficiências na interação social, padrões comportamentais restritos e repetitivos, e possíveis comorbidades como epilepsia e distúrbios gastrointestinais, as vias de sinalização imunológicas parecem estar diretamente envolvidas no desenvolvimento da doença. Semelhante à DP, onde a doença é marcada pela perda de neurônios dopaminérgicos e a acumulação de proteínas mal dobradas, o TEA apresenta alterações nos circuitos sinápticos que afetam a cognição e a função motora.
A ativação microglial, muitas vezes induzida por insultos específicos, leva à neurotoxicidade, um mecanismo imunopatológico central tanto no TEA quanto na DP. A resposta inflamatória glial, mediada por citocinas como IL-1β, IL-6, TNF-α e outros mediadores, contribui para a neurodegeneração e os sintomas observados em ambas as doenças. No TEA, essa ativação pode afetar regiões cerebrais como o córtex frontal, o cerebelo e os gânglios da base, enquanto na DP, ela afeta principalmente a substância negra, responsável pela produção de dopamina.
Em modelos experimentais, a inflamação crônica associada à microglia reativa tem sido identificada como um fator que acelera a progressão da doença. Em ambas as condições, a conversão de astrócitos protetores em uma forma neurotóxica (A1) é um fator crítico, mediado por interações com a microglia e mediadores inflamatórios. Isso sugere que a disfunção imunológica compartilhada pode ser um elo entre o TEA e a DP, com a inflamação desempenhando um papel crucial na patogênese dessas condições.
Esses insights destacam a importância de investigar os mecanismos imunológicos que se sobrepõem entre essas condições e como a inflamação, tanto na gestação quanto ao longo da vida, pode influenciar o risco e a progressão de distúrbios neuropsiquiátricos e neurodegenerativos. O entendimento desses processos pode abrir novas abordagens terapêuticas para prevenir ou mitigar os impactos desses distúrbios no cérebro humano.