Os inibidores da anidrase carbônica (IACs) são medicamentos usados para tratar diversas condições, como glaucoma, hipertensão intracraniana idiopática, mal de altitude, insuficiência cardíaca congestiva e epilepsia. Entretanto, esses medicamentos podem apresentar contraindicações importantes para quem segue a dieta cetogênica. Isso se deve principalmente ao risco de acidose metabólica, um efeito colateral que pode ser exacerbado no contexto de uma dieta rica em gorduras e com níveis elevados de cetonas no sangue.
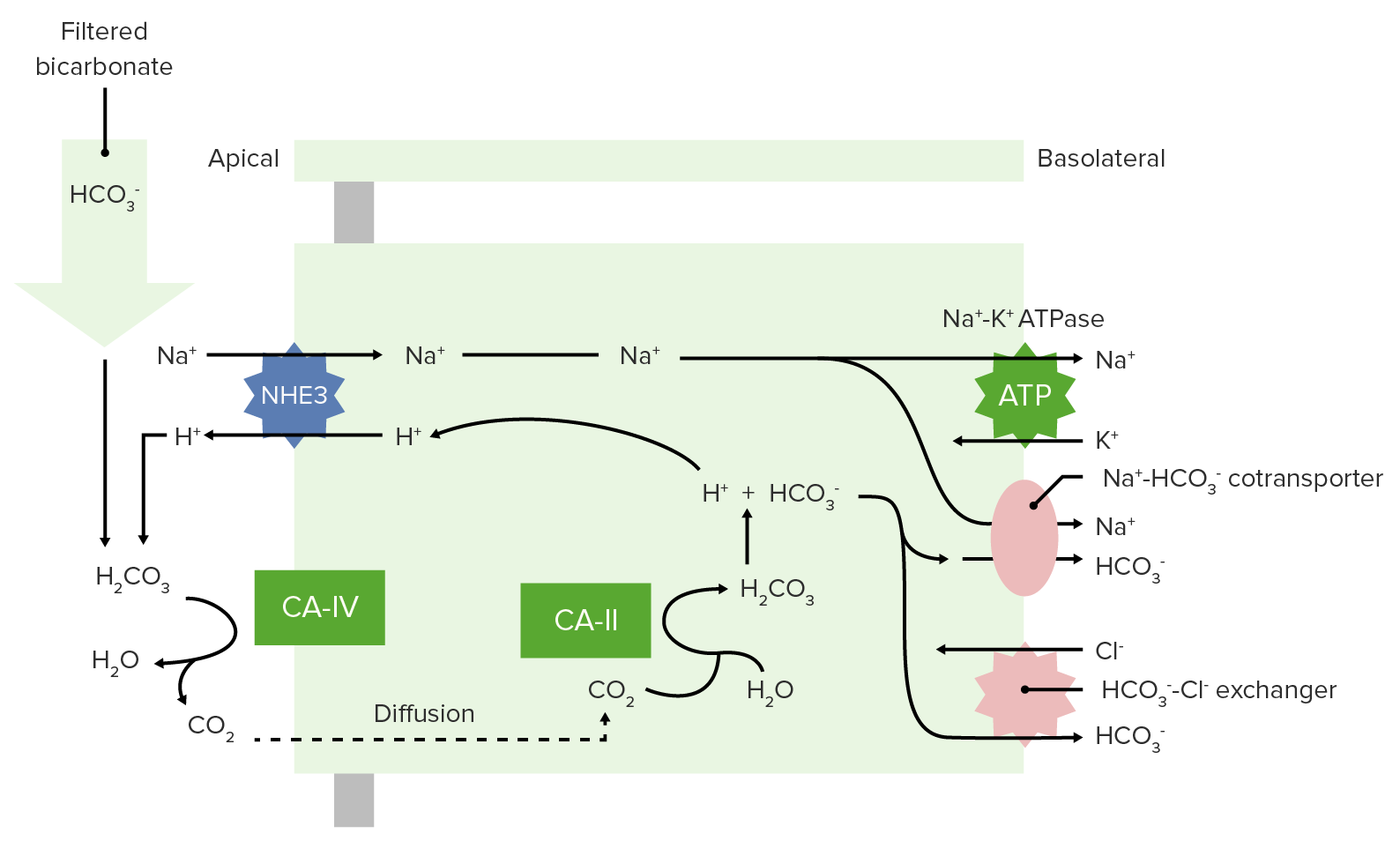
Os inibidores da anidrase carbônica (IAC) bloqueiam as enzimas da anidrase carbónica no túbulo contornado proximal, inibindo a reabsorção de bicarbonato de sódio (NaHCO 3 ), o que resulta em diurese e acidose metabólica. Os inibidores da anidrase carbónica também bloqueiam a anidrase carbónica presente nos olhos e células gliais, o que resulta na diminuição do humor aquoso e da produção de LCR, respetivamente. A acetazolamida é o prototipo de IAC.
Imagem por Lecturio. Licença: CC BY-NC-SA 4.0
Por Que Evitar Inibidores da Anidrase Carbônica na Dieta Cetogênica?
Os IACs, como acetazolamida, metazolamida, dorzolamida, brinzolamida e diclorfenamida, promovem a alcalinização urinária ao inibir a reabsorção de bicarbonato no rim. Isso resulta em um aumento da acidez no sangue, ou seja, acidose metabólica. Na dieta cetogênica, os corpos cetônicos naturalmente gerados já tornam o ambiente metabólico mais ácido, o que pode causar:
Acidose metabólica severa: Pode levar a sintomas como fadiga extrema, náusea, vômitos e confusão mental.
Alteração nos eletrólitos: Os IACs reduzem os níveis de bicarbonato, potássio e sódio no sangue, o que pode agravar os desequilíbrios eletrolíticos comuns na dieta cetogênica.
Aumento do risco de cálculos renais: A combinação de alcalinização urinária e aumento na excreção de cálcio pode favorecer a formação de cálculos renais.
Mecanismo de Ação dos IACs
Nos rins, os IACs inibem a enzima anidrase carbônica, bloqueando a reabsorção de bicarbonato no túbulo proximal.
Isso leva à retenção de bicarbonato na urina, reduzindo os níveis séricos de bicarbonato e provocando acidose metabólica.
No contexto ocular, reduzem a produção de humor aquoso, sendo eficazes no tratamento de glaucoma.
Condições Clínicas Relacionadas
Os IACs são indicados para várias condições, incluindo:
Glaucoma: Redução da pressão intraocular.
Mal de altitude: Prevenção de sintomas de hipóxia em altitudes elevadas.
Epilepsia: Controle de crises em casos específicos.
Insuficiência cardíaca congestiva: Controle do edema associado.
No entanto, seu uso deve ser evitado ou monitorado com cuidado em pacientes que seguem uma dieta cetogênica devido à maior suscetibilidade à acidose metabólica.
Alternativas aos Inibidores da Anidrase Carbônica
Para pessoas em dieta cetogênica que precisam tratar glaucoma ou outras condições, alternativas menos propensas a causar acidose metabólica podem ser consideradas, como:
Betabloqueadores tópicos (ex.: timolol) para glaucoma.
Análogos de prostaglandinas (ex.: latanoprosta).
Ajustes na dieta e suplementação para corrigir desequilíbrios eletrolíticos e minimizar o impacto metabólico.
Considerações Importantes para Profissionais de Saúde
Monitoramento Regular: Pacientes em dieta cetogênica e usando IACs devem realizar exames regulares de:
Bicarbonato sérico.
Eletrólitos (sódio, potássio).
Função renal e hepática.
Cuidados na Prescrição: Avaliar a necessidade de medicamentos que possam agravar a acidose metabólica e buscar alternativas.
Orientação ao Paciente: Esclarecer sobre os riscos e a importância de informar mudanças na dieta ao profissional responsável.
Embora os inibidores da anidrase carbônica sejam medicamentos eficazes em várias condições, seu uso deve ser cauteloso ou evitado na dieta cetogênica. O risco de acidose metabólica e alterações nos eletrólitos são fatores críticos que tornam necessária uma avaliação cuidadosa e o monitoramento contínuo do paciente. Se você toma qualquer remédio, converse com seu médico antes de iniciar qualquer alteração importante de estilo de vida.
Aprenda mais em https://t21.video