Quando o gameta masculino e o gameta feminino juntam-se, a informação genética dos pais precisa ser passada para a prole corretamente. A estabilidade do genoma é uma característica de todo organismo justamente para preservar e transmitir fielmente o material genético de geração em geração ou de uma célula somática para outra. Isto inclui uma replicação livre de erros de material genético (DNA ou RNA) e a reparação de erros de replicação ou de DNA/RNA danificado.
Em contraste, a instabilidade do genoma abrange uma vasta gama de alterações do DNA, com maior taxa de danos e mutações associadas. Indivíduos autistas com mais instabilidade genômicas apresentam mais mutações que podem se manifestar como anormalidades cromossômicas, translocações, grandes inserções ou deleções de bases nitrogenadas.
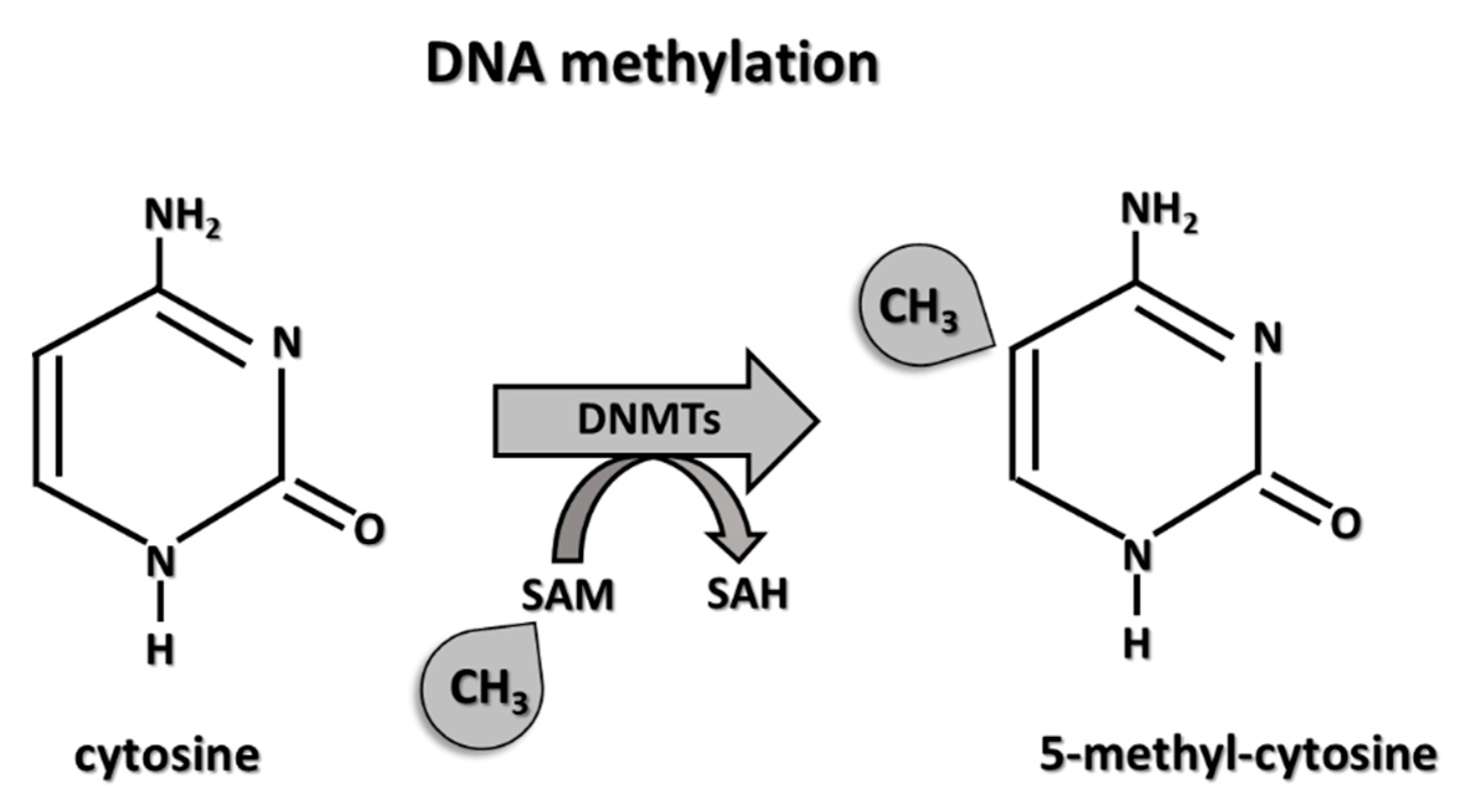
A instabilidade epigenômica refere-se às respostas alteradas na regulação da expressão gênica em resposta às flutuações no ambiente. O termo programação epigenética refere-se às mudanças moleculares reversíveis que ocorrem no DNA, RNA ou em histonas, proteínas que regulam a expressão dos genes. Esta programação não modifica a sequência de bases do DNA.
A programação epigenética da cromatina começa logo após a síntese do DNA. Alterações subsequentes podem ocorrer em resposta a uma variedade de fatores normais ou patológicos, além de alterações ambientais, como disponibilidade de nutrientes, exposição à toxinas ou estresse.
Regiões mais frágeis do genoma são mais propícias à instabilidade genômica e epigenômica. Por exemplo, pessoas com transtorno do espectro autista (TEA) parecem mais vulneráveis geneticamente a novas mutações (mutações de novo) de determinados genes. Uma das hipóteses é que indivíduos com TEA estão menos protegidas e, portanto, mais sujeitas a sofrerem mutações ao entrarem em contato com toxinas ambientais.
Quando as mutações acontecem nos gametas maternos ou paternos ou nos estágios iniciais da embriogênese, a criança apresentará mutações que não estão presentes nos pais. As mutações podem ser transmitidas aos descendentes na geração subsequente.
A prole também pode adquirir mutações em estágios posteriores de desenvolvimento, resultando em mosaicismo somático. Gene(s) impactado(s) por esses processos podem levar ao desenvolvimento e funcionamento neural aberrantes, contribuindo para o aparecimento do TEA.
O autismo está associado à instabilidade epigenômica, que é regulada tanto pelo índice de metilação global (LINE-1) quanto pelo comprimento dos telômeros. Estudo publicado em 2023 mostrou uma diminuição significativa da metilação de RTL e LINE-1 em casos autistas em relação aos controles (P < 0,001), servindo como biomarcadores para o TEA.
A hipometilação está ligada à redução no comprimento dos telômeros. Esta diminuição relaciona-se com alguns comportamentos típicos do autismo, além de sintomas sensoriais, mas não com a severidade dos casos (Salem, & Ashaat, 2023).