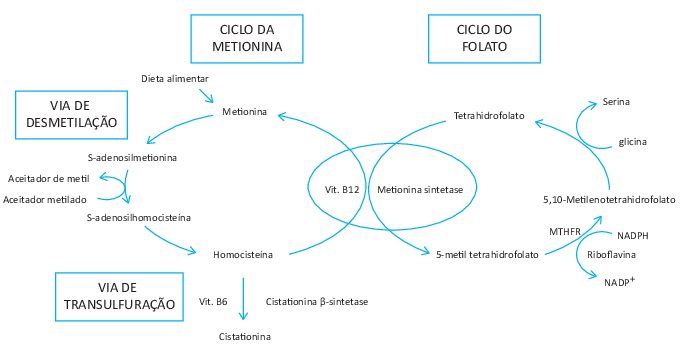
Tiques, obsessões e compulsões são questões comuns no TOC, uma condição mental grave, mais comum no sexo masculino. O transtorno obsessivo-Compulsivo (TOC), frequentemente está associado a fenômenos sensoriais e comportamentos impulsivos. Foi relatado que esses sintomas clínicos influenciam os comportamentos alimentares, mas a literatura também mostrou que os padrões alimentares ou suplementos dietéticos podem aliviar o espectro clínico, sugerindo a existência de uma associação bidirecional. A adoção de padrões alimentares mais saudáveis reduz tiques e traços obsessivo-compulsivo. Certamente, o tratamento do TOC deve ser multidisciplinar e incluir neuropsiquiatras, psicólogos clínicos e nutricionistas. O aconselhamento nutricional deve ser o mais abrangente possível para promover uma dieta balanceada e informar sobre os efeitos colaterais nutricionais dos medicamentos ou potenciais interações medicamentosas (Briguglio et al., 2019).
A dieta mediterrânea vem sendo testada. Inclui frutas, verduras, cereais integrais, alimentos locais e da estação, que promovem bem estar e longevidade. São benefícios da dieta mediterrânea:
- alto potencial antioxidante e antiinflamatório;
- potencial de regular genes;
- modulação da expressão de microRNAs, que ajudam a melhorar o metabolismo.
Padrão alimentar mediterrâneo
Muitos países são banhados pelo mar mediterrâneo. Cada um deles possui uma culinária específica, com alguns pontos em comum. Plantas nativas de cada região são as fontes mais importante de substâncias bioativas naturais, que beneficiam o perfil lipídico e a função cardiovascular. Ervas, condimentos, frutas diversas, azeite, nozes, castanhas, hortaliças são partes importantes do padrão alimentar mediterrâneo.
A dieta mediterrânea enfatiza o consumo de plantas, vegetais, refogados com cebola, alho e tomate, frutas, grão de bico, amêndoas, avelãs, azeite, azeitona, peixes e frutas do mar, além das ervas e do vinho junto às refeições. Muitos estudos mostram os benefícios deste padrão alimentar e podemos dar uma abrasileirada trocando o grão de bico pelos feijões, as amêndoas e avelãs por castanha de caju e castanha do Pará ou baru. O azeite pode ser trocado pelo abacate. Peixes mais baratos como sardinhas podem ser utilizados. Comer é bom, essencial e também um fenômeno cultural e social. Desfrute da mesa saudável com seus parentes e amigos, sem TV, com tranquilidade. Bom pro corpo e pra mente!