Processos neurodegenerativos como a demência são condições sensíveis ao tempo. Quanto mais você esperar para buscar ajuda, entender as causas dos seus problemas de memória, maiores serão os danos lá na frente.
As opções atuais de tratamento recomendadas para a doença de Alzheimer (DA) são desanimadoras. Os medicamentos atualmente aprovados, como inibidores da colinesterase e antagonistas dos receptores NMDA, controlam os sintomas por pouco tempo e não tratam as causas.
Como funcionam os medicamentos para Alzheimer?
Inibidores da colinesterase, como Donepezil (Aricept), Rivastigmina (Exelon) e Galantamina (Razadyne) agem retardando a degradação da acetilcolina, um neurotransmissor envolvido na memória e na cognição e que pode estar esgotado em pacientes com Alzheimer. Os efeitos colaterais comuns do uso da medicação são náuseas, vômitos e diarreia.
Antagonistas dos receptores NMDA como Memantina (Namenda) funcionam regulando a atividade do glutamato, outro neurotransmissor que desempenha um papel na memória e no aprendizado. A hiperatividade do glutamato pode causar danos celulares, que a Memantina tenta prevenir. Os efeitos colaterais mais comuns da memantina são tontura, dores de cabeça e confusão mental.
Embora esses medicamentos possam fornecer alívio temporário para alguns sintomas, como distúrbios de memória e confusão, eles geralmente falham em interromper ou mesmo retardar a progressão da doença.
Existem também as drogas anti-betaamilóide (anti-βA), mas as mesmas não têm mostrados bom resultados. Infelizmente, existem evidências de que podem até comprometer a saúde do cérebro a longo prazo (Alves et al., 2023).
Quais são as causas do Alzheimer?
Não compreendemos totalmente as causas da doença de Alzheimer. Contudo, o hipometabolismo glicolítico cerebral parece central na fisiopatologia da doença. Isto significa que o cérebro torna-se, ao longo dos anos, menos capaz de captar e utilizar a glicose presente em alimentos fontes de carboidratos (pães, arroz, batatas, biscoitos, macarrão, doces, frutas…). Essa alteração metabólica gera falta de energia no corpo e no cérebro, prejudicando a função neuronal e interrompendo a comunicação entre as células cerebrais.
Os neurônios são altamente dependentes de energia; mesmo um leve déficit de energia pode afetar significativamente sua capacidade de funcionar bem. Sem a utilização da glicose como combustível, as células do sistema nervoso falham na transmissão de sinais, na capacidade de formar novas conexões - essenciais para o aprendizado e a memória - e também na capacidade de limpeza.
Com o tempo, o hipometabolismo sustentado pode levar à perda de neurônios e subsequente redução do volume cerebral (encolhimento do cérebro), agravando o declínio cognitivo e aumentando a gravidade dos sintomas associados à doença de Alzheimer.
Esta não é uma questão de debate ou disputa na comunidade científica. Estudos de imagem cerebral mostraram consistentemente uma redução na captação de glicose em certas áreas do cérebro com Alzheimer. Numerosos estudos revisados por pares relacionaram essa atividade metabólica diminuída ao declínio cognitivo e à perda de memória que caracteriza a doença de Alzheimer. Assim, limitar carboidratos na dieta torna-se importante.
Outra causa das alterações relacionadas ao Alzheimer é a disfunção mitocondrial (Kalani et al., 2023). Se as mitocôndrias não funcionam bem o estresse oxidativo aumenta. Este termo descreve o desequilíbrio que ocorre em nossos corpos entre moléculas nocivas chamadas espécies reativas de oxigênio (ROS) e nossa capacidade de nos defender contra elas. No cérebro, o estresse oxidativo, ou seja, o excesso de radicais livres gera danos aos nossos neurônios, proteínas e DNA e contribui para o avanço da doença de Alzheimer.
A peroxidação lipídica é um dos resultados mais comuns do estresse oxidativo. Radicais livres começam a atacar a membrana de gordura das células, roubando elétrons e afetando a fluidez das células, a permeabilidade das membranas e a função das proteínas ligadas à elas. Algo comum é a exacerbação na produção e o acúmulo de beta-amilóide. Este peptídeo pode induzir estresse oxidativo por si só, criando um ciclo vicioso de danos. Além disso, proteínas e lipídios danificados por oxidação são propensos a formar agregados, o que pode exacerbar a formação de placas de beta-amilóide.
O papel do estresse oxidativo também é evidente na hiperfosforilação da tau, outra característica do Alzheimer. Em condições de estresse oxidativo, há aumento da ativação de várias quinases (enzimas que adicionam grupos fosfato a outras proteínas), o que pode contribui para a hiperfosforilação da tau. A tau hiperfosforilada (cheia de fósforos) é mais propensa à agregação, levando à formação de emaranhados neurofibrilares, outra característica da DA.
Além disso, o estresse oxidativo pode levar à morte neuronal na DA por meio de um processo chamado apoptose ou morte celular programada (Sharma, & Kim, 2021).
Regiões mais afetadas pelo metabolismo glicolítico cerebral
Duas regiões frequentemente afetadas pela falta de glicose são o lobo parietal e o córtex cingulado posterior. O lobo parietal, localizado próximo à parte posterior do cérebro, é responsável por várias tarefas, incluindo navegação espacial, atenção e processamento de linguagem. O comprometimento desta área faz com que o paciente perca-se com maior facilidade, tenha dificuldade para manter a atenção ou problemas para ler ou compreender a fala.
O córtex cingulado posterior, localizado no meio do cérebro, desempenha um papel vital na recuperação da memória e no controle cognitivo. A disfunção nessa área pode contribuir para dificuldades em recordar informações e tomar decisões. Ao longo do tempo várias outras regiões cerebrais vão sendo afetadas. É o caso do lobo frontal.
O lobo frontal é a sede de funções executivas como tomada de decisão, resolução de problemas e controle emocional. Torna-se hipometabólico nos estágios posteriores da doença, fazendo com que o paciente apresente mais alterações comportamentais, julgamento prejudicado e dificuldades na realização de tarefas rotineiras.
Finalmente, o lobo temporal, que abriga o hipocampo – o epicentro da memória do cérebro é afetado, tornando os sintomas cada vez mais graves. O quanto antes começarmos a cuidar do cérebro melhor. Estudos mostram que essas disfunções na verdade começam pelo menos 15 anos (possivelmente 30) antes do diagnóstico da doença.
Terapia metabólica na prevenção e tratamento do Alzheimer
Como o cérebro não está utilizando a glicose com eficiência, recomenda-se a dieta cetogênica. Esta dieta restringe carboidratos e aumenta gorduras. Isto muda o metabolismo celular, que passa a produzir corpos cetônicos, como beta-hidroxibutirato e acetoacetato. Estas substâncias estabilizam o metabolismo energético mitocondrial, tem ação antiinflamatória e podem ser utilizadas pelo cérebro como fonte de energia (Achanta, & Rae, 2017; Sridharan, & Lee, 2022; Zhu et al., 2022).
Corpos cetônicos ativam genes que permitem que mais mitocôndrias (usinas de energia das células) sejam criadas e também permitem que as já existem funcionem com mais eficiência (Dilliraj et al., 2022). Quando as mitocôndrias não funcionam bem, produzem radicais livros em excesso, envelhecendo as células e gerando sintomas relacionados ao Alzheimer (Sharma, & Kim, 2021). A dieta cetogênica mantém o estresse oxidativo sob controle.
O β-hidroxibutirato (BHB) possui propriedades antioxidantes. A redução de ROS é alcançada aumentando a eficiência da cadeia de transporte de elétrons na mitocôndria, reduzindo o vazamento de elétrons e, posteriormente, a formação de radicais livres. As dietas cetogênicas também aumentam um poderoso antioxidante endógeno conhecido como glutationa (Jarrett et al., 2008).
O aumento na produção de glutationa é possível porque a cetose promove a produção de NADPH, uma coenzima que desempenha um papel vital na regeneração da glutationa. Quando as células têm um suprimento adequado de NADPH, elas podem converter com mais eficiência a glutationa oxidada (GSSG) de volta à sua forma ativa reduzida (GSH), mantendo assim uma defesa antioxidante robusta (Milder, & Patel, 2012).
Ao apoiar a produção e a regeneração da glutationa, o BHB ajuda a manter um pool de glutationa ativa e reduzida, pronta para neutralizar as ROS e reduzir o estresse oxidativo, exibindo suas próprias propriedades antioxidantes independentes. Essa relação simbiótica entre BHB e glutationa serve para reforçar as defesas antioxidantes, particularmente importantes no cérebro, onde o estresse oxidativo pode ter efeitos devastadores.
Monitore os níveis de glicose e corpos cetônicos
APARELHOS PARA MONITORAÇÃO DE GLICOSE E CORPOS CETÔNICOS:
BRASIL - Freestyle Optium Neo
EUA - KetoMojo
Aliar medicação, treino cognitivo, atividade física e dieta cetogênica
Por que não usaríamos a dieta cetogênica como uma defesa de primeira linha contra os estragos do estresse oxidativo? Esta é uma importante terapêutica metabólica, que ao ser associada aos tratamentos clássicos, reduz os efeitos devastadores da doença.
Um acúmulo de estudos pré-clínicos e clínicos mostraram que a dieta cetogênica é benéfica para o tratamento de pacientes com Alzheimer. Além de melhorar a função mitocondrial também otimiza a composição da microbiota intestinal e reduz a neuroinflamação (Xu et al., 2023).
Também foi observado que a acetona e o β-hidroxibutirato (βHB) atuam como inibidores de glutamato no receptor NMDA, destacando especificamente a atividade exibida pelo βHB (Pflanz et al., 2019). Ao mesmo tempo que reduz neurotransmissores excitatórios, como o próprio glutamato, ajuda a aumentar os relaxantes, como o GABA (Pietrzak et al., 2022).
O ácido gama-aminobutírico (GABA) é um neurotransmissor inibitório. Seu aumento é elevante porque a sinalização GABAérgica é frequentemente perturbada em pacientes com Alzheimer. Melhorar o tônus GABAérgico pode ajudar a restaurar o equilíbrio das redes neurais interrompidas pela doença (Murakami, & Tognini, 2022).
Suplementos podem ajudar
Já falei sobre a suplementação no Alzheimer em alguns vídeos do YouTube. Mas abaixo vou falar de uma substância que ainda não discuti: a lactoferrina.
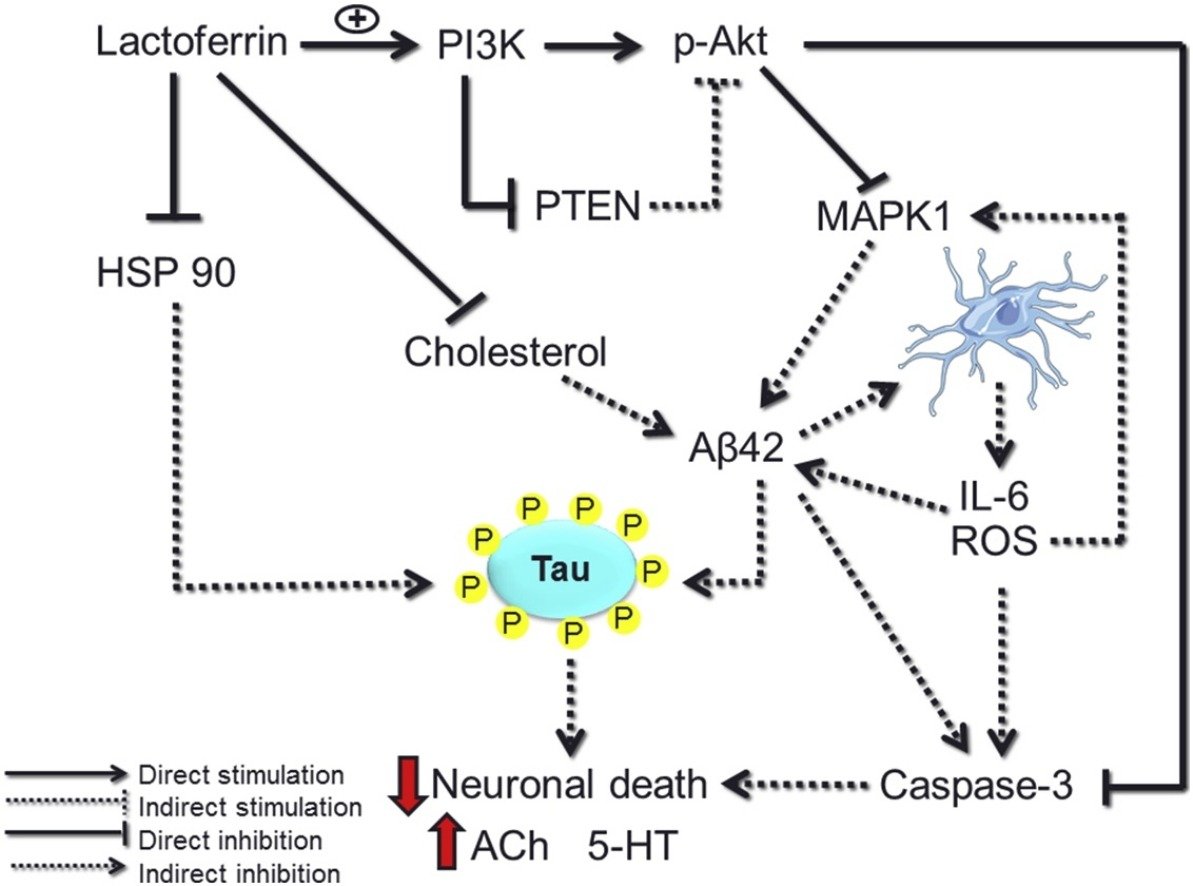
Uso da lactoferrina no Alzheimer
A lactoferrina é uma glicoproteína que liga-se fortemente ao ferro. É naturalmente secretada por fluidos corporais, incluindo leite, saliva, lágrimas, fluidos vaginais, sêmen, secreções de pulmões e nariz, bile, sucos digestivos e urina.
Tem atividade antibacteriana, aumenta as funções imunológicas e ajuda a desenvolver o sistema gastrointestinal e imunológico em recém-nascidos. O mais interessante é que um estudo mostrou que o uso de 300mg/dia de lactoferrina, por 3 meses, melhora a cognição e de vários parâmetros inflamatórios e antioxidantes de idosos (Mohamed, Salama, & Schaalan, 2019). Provavelmente por sequestrar ferro, um metal que, quando em excesso, aumenta o estresse oxidativo celular.
Suplementos contendo lactoferrina:
Brasil: Colosfort lactoferrin plus da Vitafor
Estados Unidos e Canada: Lactoferrin 95%
Europa: Premium lactoferrin
Ebook: Nutrição no Alzheimer
TERAPIAS METABÓLICAS NO ALZHEIMER
Andreia Torres é uma especialista em terapias metabólicas. Nutricionista com doutorado (UnB/Harvard) e experiência clínica de quase 30 anos. Há mais de 10 anos treina nutricionistas e médicos no uso seguro e eficaz das terapias metabólicas para o tratamento da obesidade, câncer, transtornos do neurodesenvolvimento, câncer, epilepsia, depressão, Alzheimer e transtorno bipolar. Atualmente disponibiliza vídeos de treinamento na plataforma t21.video e atende em seu consultório particular e online.
Ajudo meus pacientes a fazerem a transição para a dieta cetogênica. Marque aqui sua consulta.