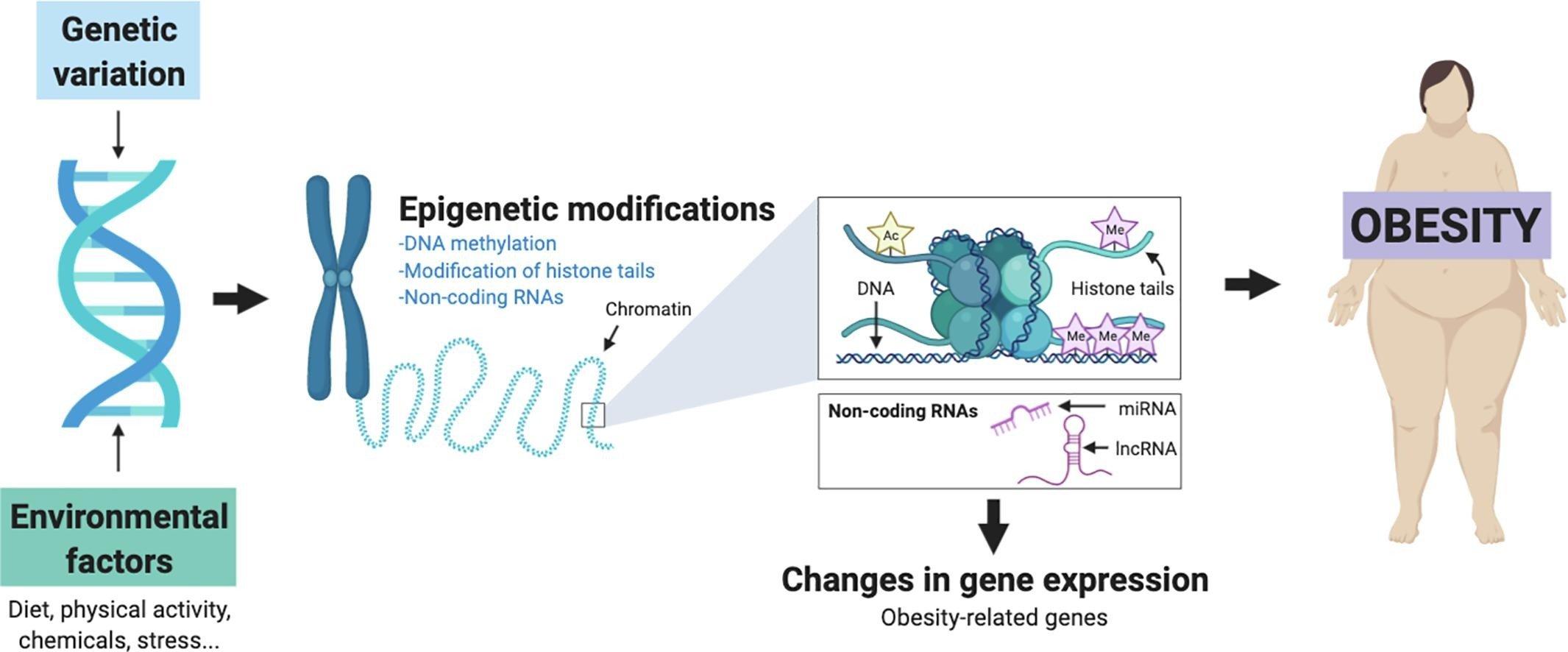
Mecanismos epigenéticos, incluindo metilação do DNA, modificações de histonas e regulação mediada por microRNA (miRNA), desempenham um papel significativo no desenvolvimento da obesidade e suas complicações [1] [2] [3].
Padrões específicos de metilação do DNA foram identificados em genes associados à adiposidade, ao metabolismo e a doenças relacionadas à obesidade, como ABCG1, IL2RB, FGF18, LEP, ADIPOQ e MACROD2/SEL1L2 [4] [5] [6].
Intervenções no estilo de vida, incluindo dieta e perda de peso, podem modificar essas marcas epigenéticas, sugerindo potencial para estratégias de prevenção e tratamento direcionadas [7] [2] [8].
Marcadores de Metilação do DNA
Numerosos estudos identificaram sítios diferencialmente metilados associados à obesidade, principalmente em células sanguíneas, tecido adiposo e células musculares esqueléticas [1] [2]. Por exemplo, um estudo de associação epigenômica (EWAS) envolvendo 1941 indivíduos identificou 40 loci CpG com níveis de metilação ligados a medidas de adiposidade, com um locus CpG (cg06500161) em ABCG1 associado a todas as quatro medidas de adiposidade (P = 9,07×10^-8 a 3,27×10^-18) [4].
Genes específicos apresentam metilação alterada na obesidade: os promotores de LEP (leptina) e ADIPOQ (adiponectina) exibiram frequência de metilação reduzida em adolescentes obesos com resistência à insulina em comparação com indivíduos magros [5]. A região do gene MACROD2/SEL1L2 apresentou hipermetilação associada ao IMC, com 19% do efeito da abundância de Ruminococcus no IMC mediado por essa metilação [6]. Além disso, o gene PM20D1 foi encontrado hipometilado em mulheres com obesidade e associado negativamente aos níveis séricos de zinco [9]. Alterações epigenéticas, particularmente padrões alterados de metilação do DNA, podem servir como biomarcadores intermediários que conectam a obesidade a doenças relacionadas, como câncer colorretal (envolvendo IL2RB e FGF18) e infarto do miocárdio [4].
Outros Mecanismos Epigenéticos e Modificabilidade
Além da metilação do DNA, modificações de histonas e regulação mediada por microRNA (miRNA) também estão implicadas na obesidade [1] [3]. A obesidade pode levar a alterações nas atividades de metilase e acetilase, afetando diretamente as modificações de histonas e a expressão de microRNA no esperma, podendo causar infertilidade masculina [10].
Fatores ambientais, incluindo exposições na primeira infância, dieta e exercícios, podem induzir alterações epigenéticas persistentes que influenciam o risco de obesidade e podem ser modificadas por mudanças no estilo de vida na vida adulta [2] [11]. Intervenções dietéticas podem levar a alterações nas marcas de metilação do DNA, perfis de expressão de miRNA e modificações de histonas associadas a desfechos de adiposidade [7].
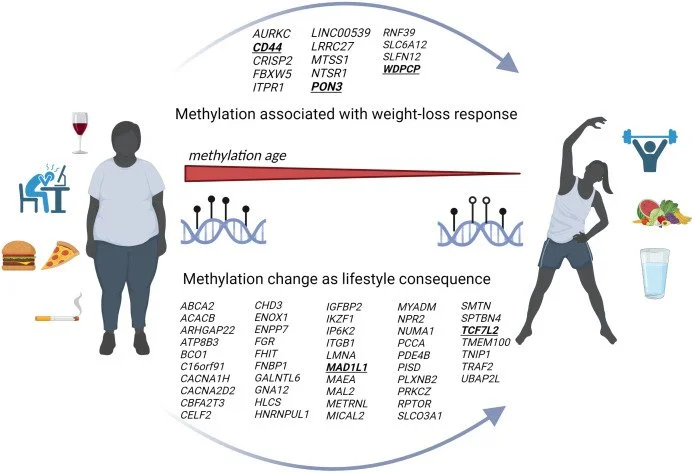
Estudos de intervenção, como uma revisão de 19 estudos de intervenção em humanos, destacam o potencial de abordagens direcionadas para alterar padrões epigenéticos associados a doenças durante a perda de peso impulsionada por mudanças no estilo de vida [8].
A perda de peso induz alterações específicas e reversíveis na metilação do DNA. Genes relacionados ao metabolismo energético, inflamação, adipogênese e sensibilidade à insulina apresentam maior modulação epigenética. A magnitude das mudanças de metilação correlaciona-se com o grau de perda de peso e melhora metabólica.
Dieta hipocalórica promove hipometilação de genes envolvidos na oxidação lipídica e no controle glicêmico. Exercício físico induz alterações epigenéticas independentes da perda de peso, especialmente em músculos e tecido adiposo. Intervenções combinadas geram efeitos epigenéticos mais robustos e sustentáveis. Manutenção do peso associa-se à estabilização parcial do perfil de metilação.
O estilo de vida é fundamental pois medicamentos não terão o mesmo efeito nos mecanismos epigenéticos. Podem potencializar a perda de peso, mas não substituem os efeitos sistêmicos, epigenéticos e sustentáveis da dieta e do exercício.
Referências
1) FY Wu et al. Recent progress in epigenetics of obesity. Diabetology & metabolic syndrome (2022). https://pubmed.ncbi.nlm.nih.gov/36397166/
2) SJ van Dijk et al. Epigenetics and human obesity. International journal of obesity (2005) (2014). https://pubmed.ncbi.nlm.nih.gov/24566855/
3) W Wen et al. Dynamic Rendition of Adipose Genes Under Epigenetic Regulation: Revealing New Mechanisms of Obesity Occurrence. Current issues in molecular biology (2025). https://pubmed.ncbi.nlm.nih.gov/40729009/
4) G Campanella et al. Epigenome-wide association study of adiposity and future risk of obesity-related diseases. International journal of obesity (2005) (2018). https://pubmed.ncbi.nlm.nih.gov/29713043/
5) MC García-Cardona et al. DNA methylation of leptin and adiponectin promoters in children is reduced by the combined presence of obesity and insulin resistance. International journal of obesity (2005) (2014). https://pubmed.ncbi.nlm.nih.gov/24549138/
6) F Salas-Perez et al. Crosstalk between Gut Microbiota and Epigenetic Markers in Obesity Development: Relationship between Ruminococcus, BMI, and MACROD2/SEL1L2 Methylation. Nutrients (2023). https://pubmed.ncbi.nlm.nih.gov/37049393/
7) O Ramos-Lopez et al. Epigenomic mechanisms of dietary prescriptions for obesity therapy. Epigenomics (2025). https://pubmed.ncbi.nlm.nih.gov/40025880/
8) S Aurich et al. Implication of DNA methylation during lifestyle mediated weight loss. Frontiers in endocrinology (2023). https://pubmed.ncbi.nlm.nih.gov/37614712/
9) NY Noronha et al. Novel Zinc-Related Differentially Methylated Regions in Leukocytes of Women With and Without Obesity. Frontiers in nutrition (2022). https://pubmed.ncbi.nlm.nih.gov/35369101/
10) CY Wang et al. [Epigenetic mechanism of obesity-induced male infertility]. Zhonghua nan ke xue = National journal of andrology (2020). https://pubmed.ncbi.nlm.nih.gov/32233240/
11) C Ling et al. Epigenetics in Human Obesity and Type 2 Diabetes. Cell metabolism (2019). https://pubmed.ncbi.nlm.nih.gov/30982733/