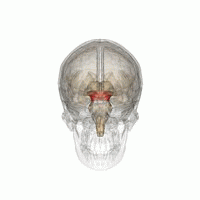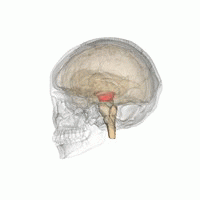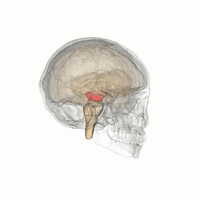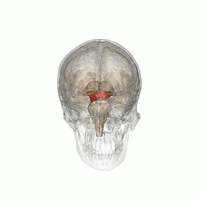
Mesencéfalo (área vermelha)
A Doença de Parkinson (DP) é um distúrbio neurodegenerativo comum tipicamente associado à perda progressiva de neurônios dopaminérgicos localizados no núcleo da substância nigra do mesencéfalo.
A marca neuropatológica da DP é a presença de inclusões citoplasmáticas, chamadas corpos de Lewy ou neurites de Lewy nos neurônios. Os corpos de Lewy são compostos principalmente de agregados de α-sinucleína (α-syn), que possuem um efeito neurotóxico. Como consequência da queda da dopamina surgem alterações motoras e não motoras, incluindo disfunções olfativas e gastrointestinais.
Alterações gastrointestinais e Parkinson
Os seres humanos desenvolveram uma relação simbiótica com seu microbioma intestinal, uma comunidade complexa composta por bactérias, archaea, protistas e vírus. O intestino possui um sistema nervoso próprio que é um portal para a comunicação bidirecional entre o cérebro e o intestino, principalmente através do nervo vago.
A α-syn é uma proteína intrinsecamente desordenada, que carece de uma estrutura 3D estável. Atualmente, investiga-se a relação entre os desequilíbrios na microbiota intestinal (disbiose) e o aumento de α-syn no cérebro.
Muitos estudos sugerem que as toxinas intestinais podem induzir a formação de agregados α-syn no sistema nervoso entérico. A quebra da proteostase, uma característica comum de muitas doenças neurodegenerativas é definida como acúmulo de proteínas mal dobradas por falta ou falha de depuração das mesmas (Santos et al., 2019).
O nervo vago possuem microtúbulos que podem levar proteínas, incluindo a alfa-sinucleína. A agregação excessiva de proteínas mal dobradas pode levar à morte celular, incluindo a degradação de neurônios dopaminérgicos.
Comunicação intestino-cérebro
A interação bidirecional entre o cérebro e o intestino é mediada por vias neurais, como o nervo vago, e humorais, como o tecido linfático e a corrente sanguínea. Uma camada única de células epiteliais separa o lúmen intestinal e o complexo microbioma intestinal dos tecidos linfoides e nervosos entéricos subjacentes.
Comunicação intestino cérebro pelo nervo vago (VN pathway, em vermelho) e outras vias (Non-VN pathway, em roxo) - Santos et al., 2019
Agregados de α-syn são encontrados no cérebro e fora dele. A α-syn da periferia pode invadir estruturas neurais vulneráveis, como o epitélio olfatório e o sistema nervoso entérico. Embora intestino e cérebro possuam barreiras imunológicas e físicas que os protegem contra insultos ambientais, essas barreiras se deterioram constantemente com o envelhecimento, viroses, autoimunidade, contato com toxinas, inflamação.
A microbiota de pacientes com DP exibe um perfil pró-inflamatório devido ao aumento da permeabilidade intestinal e presença de endotoxinas (lipopolissacarídeos bacterianos). Amilóides bacterianos também podem favorecer um ambiente pró-inflamatório no intestino.
A suplementação de bactérias probióticas tem sido associada à melhora dos sintomas gastrointestinais associados à DP, assim como redução da inflamação local e da neuroinflamação. Lactobacilos inibem a formação de biofilmes por bactérias patogênicas. Contudo, apesar do número crescente de produtos probióticos disponíveis para os consumidores e do marketing agressivo proclamando sua eficácia, existem poucos estudos abordando as preocupações sobre a eficácia e, mais importante, a segurança desses produtos. Mas podemos incluir na dieta alimentos que contenham naturalmente probióticos como iogurte, kefir e vegetais fermentados.
Redução do estresse oxidativo na doença de Parkinson
A doença de Parkinson (DP) também está associada ao estresse oxidativo e à diminuição da glutationa (GSH), sugerindo que as terapias que aumentam o GSH podem ter um efeito modificador da doença.
Uma das formas de aumentar GSH é pela administração oral ou intravenosa de alta dose de N-acetilcisteína (NAC). O NAC aumenta o GSH sanguíneo e cerebral em indivíduos com DP.
Em um estudo, pacientes com DP receberam uma alta dose de NAC por 4 semanas. O GSH cerebral foi medido no córtex occipital antes e após 28 dias do uso de 6.000 mg de NAC/dia. Como a dose foi muito alta (10 vezes maior do que a normalmente indicada para adulto) a maior parte dos pacientes tiveram efeitos colaterais.
Embora as medidas antioxidantes periféricas (catalase e GSH/GSSG) tenham aumentado significativamente em relação à linha de base, os indicadores de dano oxidativo, ou seja, as medidas de peroxidação lipídica (4-HNE e MDA) permaneceram inalterados.
Não houveram aumentos significativos no GSH cerebral, o que pode estar relacionado à baixa biodisponibilidade oral de NAC. Outros estudos precisaram avaliar se o uso intravenoso traria melhores efeitos (Coles et al., 2017).
Leia mais sobre nutrição na Doença de Parkinson clicando no link.