A doença de Parkinson (DP) é uma doença neurodegenerativa progressiva caracterizada por tremor, rigidez de movimento e dificuldade de locomoção. O comprometimento motor e a patologia cerebral característica não se apresentam como sintomas até um estágio bastante avançado da doença. A essa altura, muitos dos neurônios dopaminérgicos da substância negra, células responsáveis pelo controle motor foram perdidos ou têm axônios degenerados.
Evidências recentes propõem uma relação entre a complexidade e a diversidade dos microrganismos que habitam o intestino e a DP. Junto com um perfil alterado da microbiota gastrointestinal, ocorre uma mudança para um estado pró-inflamatório, com possíveis efeitos prejudiciais no intestino e no cérebro. Isto justifica também alguns sintomas gastrointestinais funcionais observados na DP, como constipação, que costuma ocorrer anos antes do surgimento dos sintomas motores.
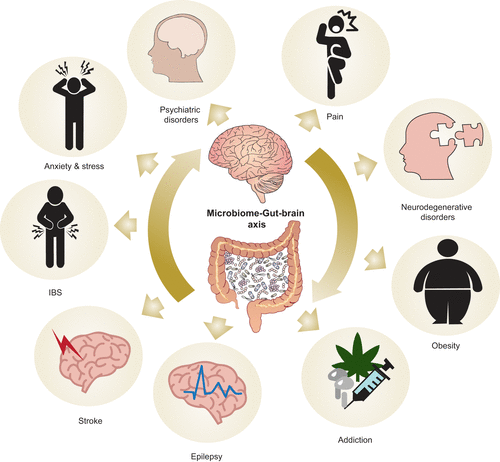
A variedade de doenças e processos de doenças nos quais a microbiota está envolvida, incluindo transtornos psiquiátricos e neurodegenerativos, dor, ansiedade, estresse, síndrome do intestino irritável (SII), derrame, compulsão e obesidade (Cryan et al., 2019)
Uma agregação da proteína α-sinucleína no cérebro é uma marca registrada da patologia de DP. Existem evidências de que a α-sinucleína no intestino pode se transportar para o cérebro. A α-sinucleína pode exercer seus efeitos via influência microbiana ou via translocação semelhante ao príon para o cérebro e pode atuar como um depósito para formas patogênicas de α-sinucleína, aumentando o risco de desenvolvimento de DP. A agregação de α-sinucleína parece ser modulada pelo metabólito microbiano intestinal LPS, uma interação bem caracterizada associada a esta via alternativa de progressão da DP.
Um valioso estudo da microbiota intestinal de pacientes com DP descreveu diferenças na composição da microbiota intestinal entre pacientes com DP e controles saudáveis. Bacteroidetes, Proteobacteria e Verrucomicrobia foram maiores em amostras fecais de DP. Os achados de diferenças de composição do micróbio intestinal na DP foram mais recentemente confirmados em uma população chinesa, com os gêneros Clostridium IV, Aquabacterium, Holdemania, Sphingomonas, Clostridium XVIII, Butyricicoccus e Anaerotruncus encontrados aumentados em pacientes com DP em comparação com controles.
Estudos mostram que intervenções probióticas e prebióticas (FOS e GOS) podem reduzir os sintomas de DP, motores, cognitivos e intestinais - pelo menos em camundongos. A expectativa é que o uso destes suplementos ajude a tratar a disbiose e reduzir a hiperpermeabilidade intestinal.
Com a disbiose, há diminuição da concentração de ácidos graxos de cadeia curta (SCFAs) na cavidade intestinal, levando à inflamação local e também afetando a expressão de proteínas da junção estreita, incluindo claudina 1 e claudina 2.
A disbiose também contribui para o aumento da permeabilidade da barreira hematoencefálica (BBB), pela diminuição da expressão de claudina 1. A diminuição da concentração de AGCC leva à disfunção da microglia. O aumento da concentração de LPS ativa a microglia, o inflamassoma NLRP3 e promove a expressão de iNOS.
A disbiose também altera o nível de dopamina produzida no intestino, agravando a sintomatologia da doença de Parkinson. Por fim, os amilóides bacterianos podem induzir uma resposta imune a αSyn no corpo humano.
Um estudo mostrou atrofia do nervo vago em pacientes com DP (Walter et al., 2018), o que pode reduzir ainda mais a concentração de dopamina no cérebro, agravando os sintomas motores, piorando a memória e as interações sociais.
TÉCNICAS PARA ESTIMULAR O NERVO VAGO
1) SOM
- Encontre um local calmo
- Coloque sua música ou mantra favorito (KALYANI, et al, 2011).
- Feche os olhos
- Cante junto
2) YOGA
A respiração lenta, a entoação de mantras como o OM, as posturas (ásanas) e as técnicas de concentração ajudam a ativar o nervo vago (STREETER et al. 2010).
3) MODULAÇÃO INTESTINAL