A mucosa intestinal é uma barreira protetora do corpo. Serve como um meio de cultivo de bactérias que formam nossa microbiota. A degradação dos glicanos de mucina pelas bactérias intestinais leva a um pool de produtos microbianos que são benéficos para a produção de muco e para as respostas imunes e metabólicas.
A maioria das proteínas plasmáticas sofre modificações pós-traducionais, uma delas é a glicosilação, que é um conjunto de reações bioquímicas sequenciais com o objetivo de sintetizar estruturas de glicanos (macromoléculas compostas por carboidratos), as quais se ligam covalentemente às proteínas formando as glicoproteínas. Estes glicanos são formados por monossacarídeos como N-acetilglicosamina, manose, galactose, ácido siálico e fucose, que ligam-se ao nitrogênio do aminoácido asparagina das proteínas.
Os glicanos de mucina são catabolizados por micróbios através de uma ação sequencial de diferentes enzimas microbianas.
As mucinas são glicoproteínas que fornecem muco com propriedades funcionais, protegendo as mucosas. São também potenciais moléculas de adesão para microganismos.
Fornecem energia e nutrientes para as bactérias, especialmente durante períodos de jejum ou quando há dieta contém pouca fibra.
O código de carboidratos da mucina é composto por N-acetilgalactosamina (GalNAc), N-acetilglucosamina (GlcNAc), galactose, fucose e ácido siálico conectados por diferentes tipos de ligação. As glicosiltransferases humanas montam esses polissacarídeos que compreendem uma ampla gama de cadeias de açúcar estruturalmente diversas.
As cadeias de oligossacarídeos contêm aproximadamente 2-20 monossacarídeos em estruturas lineares e moderadamente ramificadas, e a expressão de combinações de glicosiltransferases com diferentes especificidades de substrato leva a uma imensa diversidade de cadeias de glicanos.
A composição dos glicanos de mucina difere ao longo do comprimento do intestino e entre indivíduos, porque é parcialmente determinada por fatores genéticos. Por exemplo, a presença ou ausência de oligossacarídeos fucosilados depende do estado secretor (Se) e dos genes Lewis (Le). Essas diferenças individuais podem afetar os resultados de saúde e a composição da microbiota durante a infância e a vida adulta.
Como tal, os não-secretores de fucose têm um risco aumentado de doenças como a doença de Crohn e a doença celíaca, e têm comunidades microbianas intestinais que são distintas daquelas dos secretores de fucose. A ausência de oligossacarídeos fucosilados no leite materno está relacionada à redução da abundância de Bifidobacterium spp. no intestino infantil e um maior risco de diarréia e doença alérgica.
O leite materno humano e os glicanos de mucina apresentam características moleculares e códigos de açúcar semelhantes. Uma semeadura adequada da mucosa intestinal com micróbios no início da vida estimulará positivamente a saúde imunológica e metabólica do hospedeiro na vida adulta. Crianças nascidas por parto cesariana e que não foram amamentadas podem ter mais distúrbios metabólicos e também maior risco de doenças do sistema imunológico.
Mas dá para recuperar. O uso de alimentos contendo fibras prebióticas ou mesmo glicanos sintéticos projetados para atingir a atividade microbiana na mucosa aumentará a colonização com micróbios benéficos, e sua presença e atividade de degradação de glicano estimularão a saúde da mucosa.
(A) A distribuição de glicano de mucina é frouxa na camada externa do muco e bem entrelaçada na parte interna, mais próxima à mucosa, atuando justamente como uma barreira; (B) LabA interage com uma estrutura N-acetylgalactosamina presente na mucina formadora de gel da mucosa; (C) As bactérias decompõem glicanos em oligossacarídeos sob a ação da glicosidase e a utilizam; (D) os peptídeos antimicrobianos (AMPs) no muco inibem bactérias patogênicas no intestino.
Muitos micróbios alimentam-se de glicanos de mucina
O microbioma da mucosa estimula as células hospedeiras para uma resposta imune e metabólica saudável. As células caliciformes do hospedeiro respondem a estímulos microbianos modificando os padrões de expressão de glicanos, e isso leva a um aumento na espessura do muco e a uma composição de glicanos de mucina modificada. Em um estado insalubre, em que a camada mucosa é fina e comprometida, os micróbios podem atingir as células epiteliais do intestino e evocar uma resposta inflamatória. A restauração do desequilíbrio da mucosa pode ser estabelecida através da adição de glicanos prebióticos semelhantes à mucina que são catabolizados por micróbios para que esses micróbios possam impulsionar o hospedeiro para restaurar a espessura do muco e estimular uma resposta imune e metabólica benéfica.
O microbioma codifica inúmeras enzimas ativas de carboidratos (CAZymes) com o potencial de degradar as complexas cadeias de polissacarídeos de glicanos de mucina. Como apenas glicanos curtos podem ser transportados para dentro da célula microbiana, são necessárias várias enzimas extracelulares secretadas e ligadas à membrana para pré-digerir os glicanos de mucina grandes. A principal atividade enzimática necessária é a das glicosil hidrolases (GHs), como endo-β-N-acetilgalactosaminidase, fucosidases, N-acetil-β-hexosaminidases, β-galactosidases e sialidases.
A degradação completa dos polissacarídeos de mucina pode ser feita por uma combinação de enzimas que podem ser expressas por uma gama diversificada de micróbios intestinais. A microbiota intestinal altamente diversificada expressa diferentes enzimas com capacidades semelhantes de degradação de muco. O fato de os micróbios usarem a degradação extracelular permite que as comunidades microbianas compartilhem fontes de carbono e quebrem de forma colaborativa os glicanos de mucina.
(A) Monômeros de açúcar presentes em estruturas de mucina. (B) Estrutura hipotética complexa de mucina glicana com uma série de ligações; as setas representam enzimas hidrolisantes codificadas no microbioma intestinal. (C) Esquerda. Estruturas de glicano de mucina bem caracterizadas e suas ligações residuais. Meio. Enzimas microbianas ativas de carboidratos (CAZymes) envolvidas no catabolismo de cada estrutura de glicano. À direita: gêneros representativos dos principais filos bacterianos no intestino humano que codificam essas enzimas ou CAZymes (Belzer, 2022).
Estratégias nutricionais para modulação da microbiota
Estratégias terapêuticas baseadas na microbiota possuem grande potencial para o tratamento de doenças e distúrbios infecciosos, imunológicos e metabólicos. Uma abordagem seria usar glicanos prebióticos sintéticos como moduladores do microbioma para estimular a barreira do muco, propriedades imunológicas e metabólicas.
O problema é que ao longo das últimas décadas, mudanças no modo de parto e alimentação infantil, uso de antibióticos e alimentação desbalanceada impactaram o estabelecimento de simbioses microbianas benéficas ao hospedeiro.
Fórmulas infantis vêm sendo adicionadas de prebióticos à base de glicano – como disialilacto-N-tetraose, galacto-oligossacarídeos sialilados, disialilacto-N-tetraose e 2'-fucosilactose – reduzindo o risco de doenças como enterocolite necrosante.
Um número crescente de estudos tem mostrado que o muco intestinal atua como um importante modulador da saúde humana, aumentando a função da barreira intestinal e diminuindo as respostas inflamatórias. A manutenção de um intestino saudável através do encapsulamento normal do muco de pelotas fecais pode até prevenir a inflamação e a hiperplasia.
Existem também alguns exemplos de uma relação causal entre micróbios degradantes de mucina e a saúde imunológica e metabólica do hospedeiro, como a descoberta de que parte da membrana externa de Akkermansia muciniphila pode evocar uma resposta metabólica saudável do hospedeiro e aumentar a função da barreira intestinal.
Uma dieta pobre em fibras vegetais reduz a abundância de Akkermansia muciniphilia dentro do nosso intestino. Em condições normais, este organismo desempenha um papel importante na regulação da qualidade e espessura da camada de muco que faz parte da barreira que separa o interior do nosso intestino do nosso sistema imunológico.
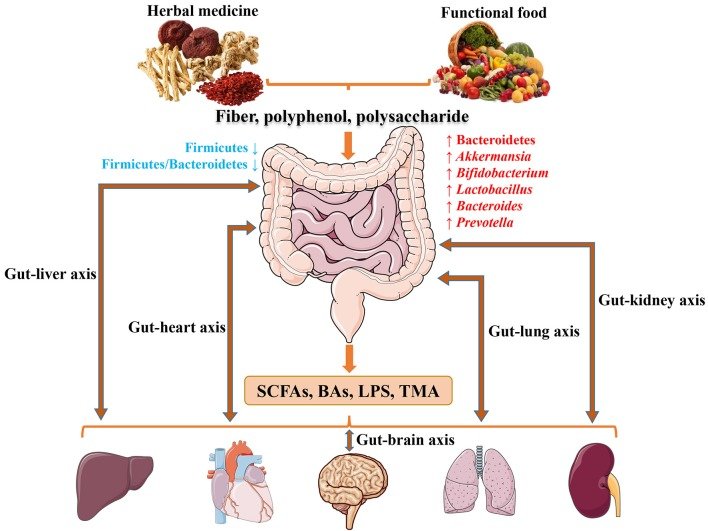
Tanto os fitoterápicos quanto os alimentos funcionais contêm fibras, polifenóis e polissacarídeos, exercendo atividades semelhantes aos prebióticos na prevenção e tratamento de doenças crônicas. Fitoterápicos e alimentos funcionais levam ao aumento da abundância do filo Bacteroidetes e dos gêneros Akkermansia, Bifidobacteria, Lactobacillus, Bacteroides e Prevotella, ao mesmo tempo em que reduziram o filo Firmicutes e a relação Firmicutes/Bacteroidetes no intestino.
Estratégias nutricionais adequadas melhoram a microbiota e a saúde de vários órgãos (Lyu et al., 2017).
Fora isso, a utilização de materiais microbianos não vivos (pós-bióticos), como as proteínas da A. muciniphila (biomamps), em vez de células microbianas viáveis (probióticos), apresenta muitas vantagens na produção a montante e possibilidades de aplicação de produtos que podem ser adicionados à nutrição.