Neurotransmissores são moléculas químicas que mediam a transmissão de sinais entre neurônios através da fenda sináptica. Eles modulam funções centrais como cognição, memória, emoções, movimento, atenção e comportamento ao se ligarem a receptores específicos e ativarem respostas excitatórias ou inibitórias. Alterações na homeostase desses mensageiros estão diretamente associadas a disfunções do sistema nervoso central e a uma variedade de desordens neurológicas e psiquiátricas.
Implicações em doenças neurológicas específicas
Doença de Alzheimer: a depleção de acetilcolina, crucial para aprendizagem e memória, devido à degeneração de neurônios colinérgicos no hipocampo, correlaciona-se com declínio cognitivo. Glutamato em excesso pode levar à excitotoxicidade via superestímulo de receptores NMDA, promovendo dano neuronal e agravamento da neurodegeneração.
Doença de Parkinson: perda de neurônios dopaminérgicos na substância negra reduz dopamina, fragiliza a função dos gânglios da base e causa tremores, rigidez e bradicinesia. O desequilíbrio entre dopamina e acetilcolina e o aumento subsequente da atividade glutamatérgica contribuem para a sintomatologia motora.
Esquizofrenia: disfunção dopaminérgica manifesta-se como hiperatividade na via mesolímbica (sintomas positivos) e hipoatividade no córtex pré-frontal (sintomas negativos). Anormalidades nos sistemas serotoninérgicos, especialmente nos receptores 5-HT2A, modulam humor e cognição.
Depressão: déficits de serotonina, norepinefrina e dopamina afetam regulação de humor, energia e recompensa, associando-se a tristeza persistente, fadiga e anedonia.
Epilepsia: desequilíbrio entre glutamato (excitador) e GABA (inibidor) facilita hiperexcitabilidade neuronal e geração de crises. Deficiências na neurotransmissão GABAérgica e excesso de glutamato/NMDA são fundamentais na fisiopatologia convulsiva.
Transtornos de ansiedade: a redução da sinalização GABAérgica e de serotonina está associada a hiperatividade neural, vulnerabilidade ao estresse e resposta emocional desregulada.
Mecanismos subjacentes à disfunção dos neurotransmissores
Fatores genéticos: mutações em genes que codificam enzimas de síntese (ex. COMT), transportadores (SERT, DAT) ou receptores (DRD2) alteram níveis, recaptação e sensibilidade de neurotransmissores, contribuindo para doenças como Parkinson, esquizofrenia e transtornos do humor.
Fatores ambientais: estresse crônico eleva cortisol e modifica expressão de receptores de serotonina e dopamina; toxinas e infecções prejudicam síntese e transporte; deficiências nutricionais (vitamina B6, folato, magnésio) comprometam vias biossintéticas.
Neurodegeneração e inflamação: citocinas inflamatórias (TNF-α, IL-1β) e microglia ativada alteram síntese e função de neurotransmissores, intensificam excitotoxicidade glutamatérgica e promovem estresse oxidativo, acelerando lesão neuronal em Alzheimer e Parkinson.
Plasticidade sináptica: glutamato/NMDA é central para potenciação de longa duração (LTP); disfunções nesses sistemas prejudicam formação e manutenção de conexões sinápticas, afetando aprendizagem e memória.
Receptores disfuncionais: alterações em receptores dopaminérgicos (D1/D2) e GABAérgicos amplificam desequilíbrios sinápticos e sintomas clínicos em esquizofrenia e epilepsia; mudanças em 5-HT1A e 5-HT2A influenciam humor e ansiedade.
Excitotoxicidade: excesso de glutamato provoca influxo de Ca2+, disfunção mitocondrial, estresse oxidativo e morte neuronal, contribuindo para neurodegeneração.
Detecção e avaliação analítica de neurotransmissores
HPLC-MS: quantifica com alta sensibilidade neurotransmissores e metabólitos em amostras biológicas (líquor, plasma, tecido), útil em Parkinson, depressão e esquizofrenia.
Limitações: Não avalia liberação sináptica dinâmica nem atividade em tempo real, refletindo concentração total tecidual ou periférica, não função sináptica. Alta sensibilidade a variáveis pré-analíticas dieta, fármacos, horário, estresse. Diferença entre níveis periféricos e centrais limita inferência sobre SNC. Custo elevado, necessidade de equipamentos e operadores especializados.
PET: imagens com traçadores radiomarcados permitem mapear receptores/transportadores dopaminérgicos e serotoninérgicos in vivo.
Limitações: Baixa resolução temporal para eventos rápidos de neurotransmissão, avalia densidade/ocupação de receptores e transportadores, não níveis absolutos de neurotransmissores, uso de radiofármacos implica exposição à radiação ionizante, alto custo e baixa disponibilidade clínica, interpretação dependente de modelos matemáticos e cinética do traçador, sensível a medicações concomitantes que competem pelos mesmos receptores.
Análise de líquor: mensura níveis de acetilcolina, glutamato e outros, oferecendo marcadores diagnósticos para Alzheimer e outras patologias.
Limitações: Procedimento invasivo com risco clínico cefaleia pós-punção, sangramento, infecção, não reflete necessariamente concentrações sinápticas regionais específicas, alta variabilidade interindividual e influência do fluxo liquórico, pouca aplicabilidade para monitoramento seriado, limitações éticas e práticas para uso populacional amplo.
Metabolômica: permite a identificação e quantificação simultânea de neurotransmissores, precursores, metabólitos e produtos de degradação em fluidos biológicos e tecidos. Utiliza principalmente LC-MS/MS, GC-MS e NMR de alta resolução. Alta aplicabilidade para monitoramento ao longo do tempo. Aprenda mais sobre metabolômica aqui.
Limitações: baixa especificidade para atividade sináptica em tempo real, influência de dieta, microbiota, fármacos e ritmo circadiano, diferença entre metabolismo periférico e central.
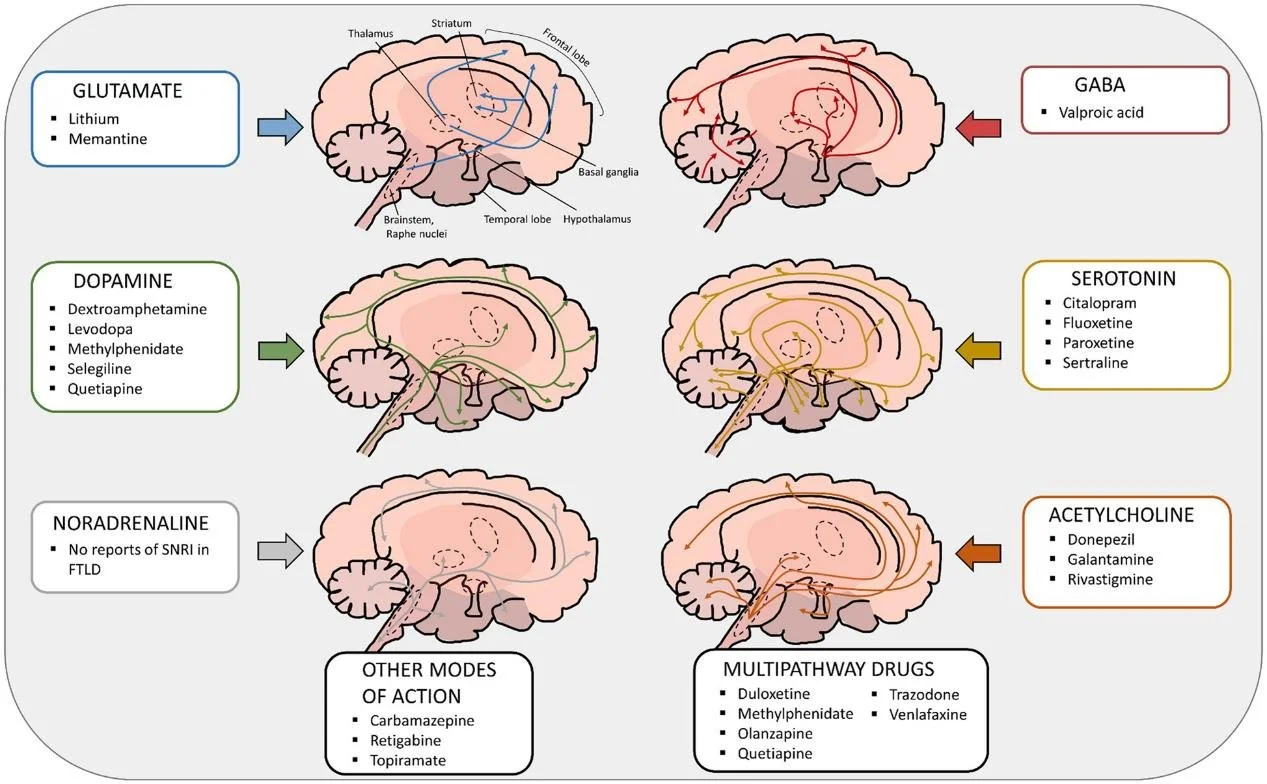
Drogas que afetam as vias de neurotransmissão
Diferentes medicações atuam modulando síntese, liberação, recaptação, degradação enzimática ou ligação receptor-dependente, alterando excitabilidade neuronal, plasticidade sináptica e expressão clínica de transtornos neurológicos e psiquiátricos.
Existem relações funcionais complexas entre diferentes sistemas neuroquímicos no tecido nervoso que modulam respostas neuronais e circuitos comportamentais.
Interações entre neurotransmissores
Interações entre neurotransmissores referem-se à influência que um sistema de mensageiros exerce sobre outro, incluindo modulação de liberação, ação sináptica e resposta pós-sináptica. Essa interação pode ocorrer por meio de mecanismos diretos (por exemplo, um neurotransmissor afetando a excitabilidade ou liberação de outro) ou indiretos (ativação de heterorreceptores que regulam síntese/liberação de neurotransmissores distintos).
As interações não são meramente soma de efeitos isolados de um único mensageiro, mas envolvem regulação recíproca, compensação adaptativa e modulação de liberação e receptividade sináptica entre múltiplos neurotransmissores. Esses mecanismos são fundamentais para a integração de sinais no cérebro e para a homeostase de redes neurais superiores.
Mecanismos de interação
Modulação de liberação presináptica: Neurotransmissores podem atuar em receptores presinápticos (incluindo heterorreceptores) para facilitar ou inibir a liberação de outros mensageiros. Isso altera a quantidade de neurotransmissor disponível para ligação pós-sináptica e, portanto, influencia o padrão de sinalização no circuito.
Regulação recíproca e compensatória: Em exemplos clássicos, a ativação de neurônios GABAérgicos no VTA reduz a atividade de neurônios dopaminérgicos, modulando a liberação de DA em sistemas de recompensa; diminuições de DA podem alterar a dinâmica de glutamato através de receptores NMDA/AMPA e, via mecanismos compensatórios, modular novamente DA.
Sinergia e antagonismo de ação: Transmissores podem exercer efeitos sinergísticos (aumento da resposta neural combinada) ou antagonistas (um mensageiro diminuindo o efeito do outro) em populações neuronais compartilhadas, influenciando excitabilidade geral e equilíbrio entre vias excitatórias e inibitórias.
Cotransmissão e coexpressão: Neurônios frequentemente coexpressam e liberam dois ou mais mensageiros (por exemplo, GABA e glicina, ou glutamato e acetilcolina), permitindo uma combinação de efeitos rápidos e moduladores no mesmo terminal sináptico.
Implicações de circuitos e disfunção
Esse entrelaçamento de sistemas é crucial para funções cognitivas como atenção, motivação, aprendizagem e humor. Desequilíbrios em interações neurotransmissoras podem contribuir para transtornos neurológicos e psiquiátricos complexos, nos quais alterações específicas em um mensageiro isolado não explicam plenamente o fenótipo clínico. A investigação dessas interações, por métodos como microdiálise simultânea e neuroimagem molecular, revela perfis de desregulação múltipla em condições como TDAH, depressão e esquizofrenia.
Aprenda mais sobre cérebro e neurotransmissores em https://t21.video