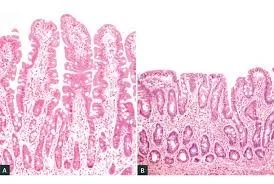
A doença celíaca (DC) é uma condição autoimune desencadeada pela ingestão de glúten — proteína presente no trigo, centeio e cevada. Em pessoas geneticamente predispostas, o sistema imunológico reage de forma exagerada ao glúten, atacando a mucosa do intestino delgado. Essa agressão danifica as vilosidades intestinais (estruturas em forma de “dedinhos” que aumentam a área de absorção dos nutrientes).
Quando essas vilosidades ficam achatadas, o organismo perde a capacidade de absorver adequadamente vitaminas, minerais, proteínas e gorduras.
A doença celíaca geralmente cursa com dor abdominal, diarreia, inchaço. Mas a DC vai muito além do intestino. Um tema que vem chamando atenção dos pesquisadores é a relação entre a doença celíaca, a dieta sem glúten (DSG) e a doença hepática gordurosa associada à disfunção metabólica (DHGDM), novo nome para a antiga NAFLD).
O fígado também pode sofrer com a DC, e em alguns casos, a própria dieta sem glúten pode contribuir para problemas metabólicos que favorecem o acúmulo de gordura no fígado.
Como a doença celíaca pode afetar o fígado?
A inflamação intestinal típica da DC pode alterar a absorção de nutrientes e aumentar a permeabilidade do intestino (“intestino mais poroso”), o que permite que substâncias inflamatórias atinjam o fígado. Resultado: em alguns pacientes, surgem alterações hepáticas, desde transaminases elevadas até gordura acumulada no fígado.
Além disso, pessoas com DC costumam ter maior risco de doenças autoimunes e metabólicas (como diabetes tipo 1), que também pesam no fígado.
A dieta sem glúten
A dieta sem glúten é o único tratamento eficaz para a DC, mas ela tem um efeito duplo:
Lado positivo: cicatriza o intestino, melhora a absorção de nutrientes e reduz a inflamação sistêmica.
Lado negativo: muitos produtos sem glúten industrializados têm mais calorias, gorduras e açúcares e menos fibras do que os equivalentes com glúten. Isso pode levar a ganho de peso, resistência à insulina e alterações no colesterol — todos fatores que aumentam o risco de MASLD.
Ou seja: a dieta sem glúten é indispensável, mas precisa ser feita de forma equilibrada, com orientação nutricional, para não trocar um problema por outro.
O que mostram os estudos?
Pesquisas ainda trazem resultados mistos: alguns trabalhos indicam que pessoas com DC têm mais gordura no fígado; outros não veem diferença. Mas há um padrão que aparece com frequência: após iniciar a dieta sem glúten, muitos pacientes ganham peso — e isso parece estar ligado ao maior risco de desenvolver esteatose hepática.
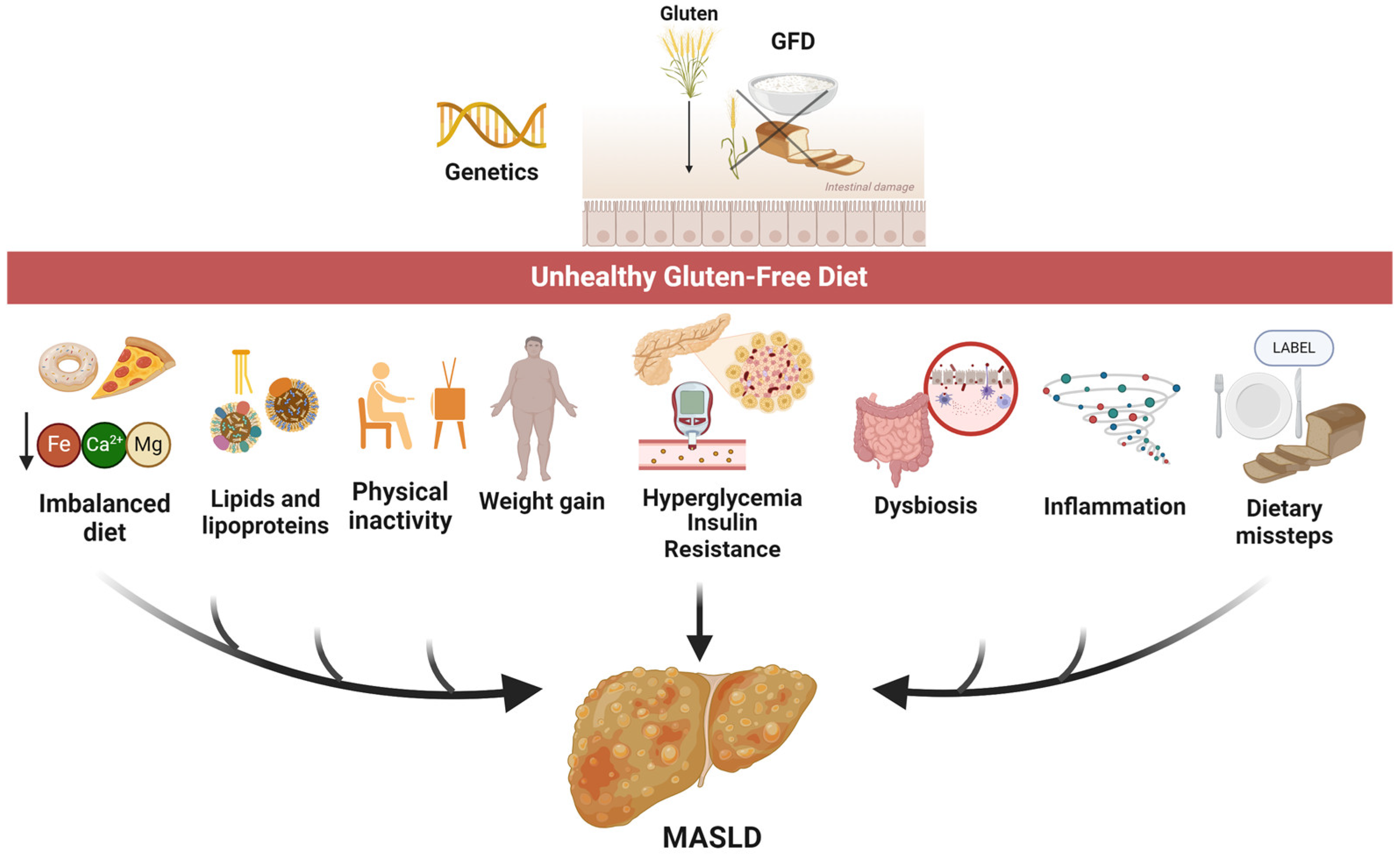
O elo entre doença celíaca e fígado gorduroso (Cazac et al., 2024)
Imagine uma teia de aranha. No centro está a doença celíaca, e ao redor dela, vários fios que chegam até o fígado: inflamação, alterações da microbiota intestinal, má absorção de nutrientes, doenças autoimunes associadas. Todos esses caminhos podem, de alguma forma, levar ao acúmulo de gordura no fígado. A DC pode impactar o fígado por diferentes vias, não apenas pelo intestino inflamado.
Dieta sem glúten precisa ser saudável, limitada em alimentos ultraprocessados e rica em alimentos in natura (Cazac et al., 2024)
A dieta sem glúten cura o intestino e reduz a inflamação. Por outro, quando baseada em produtos industrializados, ela aumenta calorias, açúcares e gorduras, favorecendo ganho de peso e síndrome metabólica. Não basta cortar o glúten, é preciso adotar uma dieta sem glúten saudável.
Você sabe interpretar este exame?
A pessoa acima não tem a genética típica do paciente celíaco. Ensino esta interpretação no vídeo:
Se você tem doença celíaca, seguir a dieta sem glúten é essencial. Mas prefira alimentos naturalmente sem glúten (arroz, milho, quinoa, frutas, verduras, carnes frescas) em vez de ultraprocessados sem glúten. Monitore não só a cicatrização intestinal, mas também peso, colesterol, glicemia e fígado, B12, folato, ferro…
Precisa de ajuda? Marque aqui sua consulta de nutrição online