Quase um século atrás, Otto Warburg descobriu que os tumores consomem muito mais glicose do que a maioria dos tecidos saudáveis. Além disso, em vez de usar essa glicose para gerar energia por meio da respiração celular, como ocorre em células normais, os tumores a convertem principalmente em lactato por fermentação. Esse fenômeno é chamado de “glicólise aeróbica” porque, ao contrário da fermentação que ocorre por falta de oxigênio, essa via metabólica acontece mesmo quando o oxigênio está disponível. A glicólise aeróbica é uma característica marcante das células cancerígenas em crescimento e, nesse contexto, é conhecida como efeito Warburg.
Glicólise Aeróbica e Proliferação Celular: Um Enigma Metabólico
A relação entre glicólise aeróbica e proliferação celular tem sido um dos grandes questionamentos da biologia celular. Embora menos eficiente na produção de ATP do que o metabolismo oxidativo, a glicólise aeróbica parece favorecer o crescimento celular. Mas por quê?
A Glicólise e a Necessidade de Precursores Biossintéticos
Uma das explicações para esse fenômeno é que a elevada captação de glicose fornece precursores biossintéticos essenciais para a síntese de lipídeos, nucleosídeos e proteínas. No entanto, a maior parte da glicose consumida é excretada como lactato, sugerindo que a glicose não é a principal fonte de biomassa celular. Outra hipótese é que a glicólise aeróbica facilita a produção de transportadores de elétrons, como NADPH e NAD+.
O Papel do Piruvato e da PDH na Regulação da Glicólise
O destino do piruvato é fundamental para a decisão metabólica entre fermentação e oxidação mitocondrial. A enzima piruvato desidrogenase (PDH) direciona o piruvato para o ciclo do ácido tricarboxílico (TCA), enquanto as quinases (PDK) inibem essa rota, favorecendo a fermentação. Estudos demonstraram que a supressão da PDK reduz o crescimento de células cancerosas, pois impede a glicólise aeróbica e compromete a regeneração do NAD+.
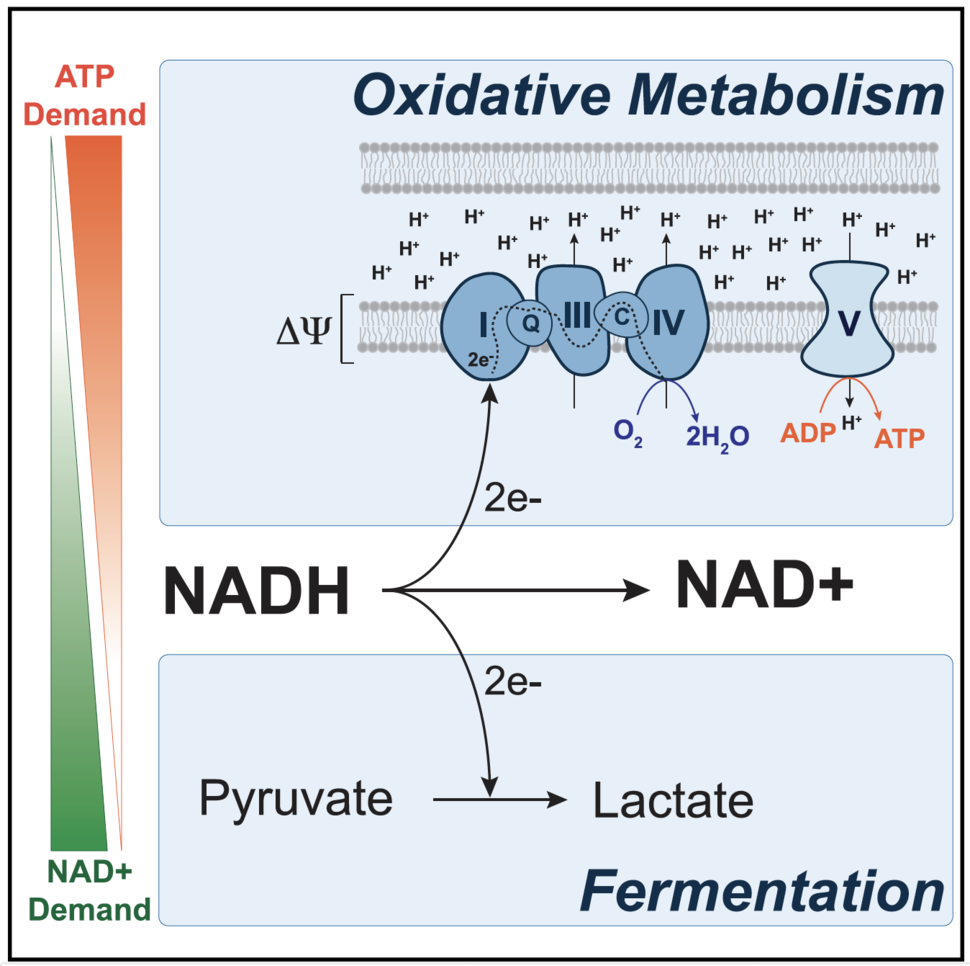
NAD+ e a Limitação da Fosforilação Oxidativa
O NAD+ é essencial para vários processos celulares e sua regeneração ocorre via cadeia de transporte de elétrons (ETC) na mitocôndria. Entretanto, em células proliferativas, a ETC pode ser limitada pelo acúmulo do gradiente de prótons, que inibe termodinamicamente sua atividade. Experimentos mostraram que dissipar esse gradiente melhora a regeneração de NAD+ e restaura a proliferação celular, sugerindo que a ATP sintase, responsável por converter esse gradiente em energia, pode ser insuficiente para aliviar essa restrição.
ATP: Um Fator Limitante?
Embora a glicólise aeróbica gere menos ATP por molécula de glicose, os dados sugerem que o ATP não é um fator limitante para a proliferação celular. Pelo contrário, um excesso de ATP pode restringir a atividade mitocondrial. Estudos indicam que células cancerosas aumentam a perda de ATP e que altos níveis dessa molécula podem prejudicar o crescimento tumoral. Isso reforça a ideia de que vias que promovem o consumo de ATP favorecem a proliferação celular.
A glicólise aeróbica não é simplesmente uma falha metabólica, mas sim uma estratégia celular para garantir a regeneração do NAD+. Em situações de alta demanda desse cofator, a fermentação pode complementar a fosforilação oxidativa, permitindo a proliferação celular mesmo quando a capacidade mitocondrial de regenerar NAD+ é limitada. Esse modelo ajuda a entender por que células proliferativas, como as cancerosas, frequentemente adotam a glicólise aeróbica, apesar de sua ineficiência energética.