Nos últimos anos, a ciência tem mostrado cada vez mais como a nutrição impacta o funcionamento do cérebro. Entre os protagonistas dessa história estão os radicais metil, o ácido fólico e o metabolismo dos neurotransmissores.
O papel da doação de radicais metil
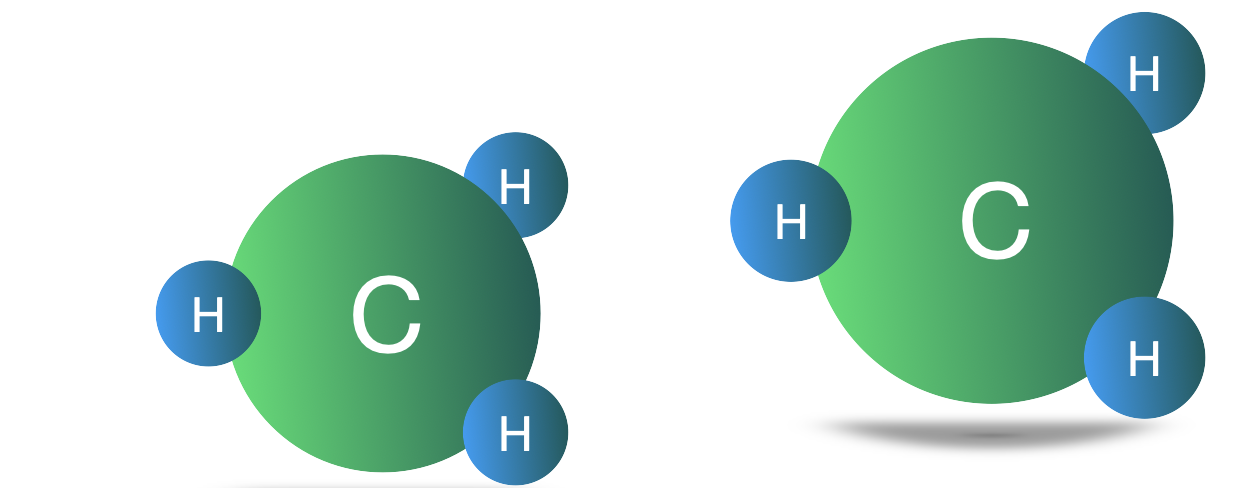
Os radicais metil (-CH3) são como pequenas “chaves” químicas que ligam ou desligam processos no nosso corpo. Quando falamos em cérebro, eles participam ativamente da síntese e regulação de neurotransmissores como serotonina, dopamina e noradrenalina – substâncias que controlam humor, atenção, memória e sono.
O processo de adição de grupos metil (uma molécula de um carbono e três hidrogênios) a outras moléculas é conhecido por metilação. Pense nisso como se o corpo usasse grupos metil como uma espécie de "moeda" biológica para fazer as coisas acontecerem por todo o corpo, catalisando múltiplas reações em muitos sistemas diferentes. A metilação é tão onipresente que acontece em segundo plano o tempo todo, bilhões de vezes por segundo!
Existem muitas enzimas diferentes no corpo que utilizam grupos metil. Aliás, qualquer enzima que seja uma "metiltransferase" (terminada com as iniciais MT – por exemplo, a enzima COMT, que desintoxica o estrogênio e os hormônios do estresse) também desempenha um papel muito importante na modificação epigenética, onde grupos metil podem ser usados para inativar partes do nosso código genético por meio da metilação do DNA.
Se o organismo não consegue doar metil de forma eficiente, podem surgir alterações na produção desses neurotransmissores, o que está associado a quadros como depressão, ansiedade, fadiga e déficit cognitivo.
Ácido fólico e metabolismo
O principal suprimento de grupos metil do corpo frequentemente vem de uma substância chamada SAMe (S-adenosil metionina), um produto dos ciclos do folato e da metionina trabalhando juntos. Há uma série de outros subprodutos vitais desses ciclos que também contribuem para outras funções importantes. Por exemplo, o ciclo do folato converte folatos alimentares em 5-MTHF (metil folato), mas no processo também ajuda a sintetizar purinas e timidina, que são necessárias para a replicação e reparo celular.
O 5-MTHF também atua como um cofator para a biopterina (BH4), que é vital para a produção dos neurotransmissores serotonina e dopamina, e dos hormônios adrenalina e noradrenalina. A biopterina também auxilia na produção de óxido nítrico, que promove a circulação e a pressão arterial saudáveis. O ciclo da metionina, na verdade, recicla um metabólito negativo chamado homocisteína, cujos altos níveis estão ligados a doenças cardiovasculares e neurodegeneração, para produzir SAMe, que ajuda a manter a homocisteína em um nível normal.
O ácido fólico (vitamina B9) é um dos nutrientes-chave para o ciclo de metilação. Ele é convertido em formas ativas dentro do corpo, que permitem a regeneração da metionina a partir da homocisteína, um processo essencial para manter o fornecimento de radicais metil.
Quando há deficiência de folato, esse ciclo se compromete e a homocisteína pode se acumular no sangue – um marcador de risco não só para doenças cardiovasculares, mas também para disfunções neurológicas.
Garantir uma boa ingestão de folato por meio da alimentação (vegetais verdes escuros, leguminosas, fígado) ou, em alguns casos, suplementação orientada por profissional de saúde, pode ser um passo importante para manter a saúde cerebral e emocional em equilíbrio.
O padrão-ouro: Teste do Formiminoglutamato (FIGLU)
Para avaliar se o organismo está aproveitando corretamente o folato, existe um exame considerado padrão-ouro: a dosagem de formiminoglutamato (FIGLU).
O FIGLU se acumula quando há deficiência de ácido fólico, sendo assim um indicador sensível do metabolismo dessa vitamina. Embora pouco solicitado na prática clínica, é um teste de grande valor em pesquisas e em situações onde se suspeita de deficiência funcional de folato, mesmo quando os níveis séricos parecem normais.
Quer aprender a avaliar exames metabolômicos e metabólitos como FIGLU? Inscreva-se aqui.