O exercício é uma das melhores maneiras de melhorar a saúde e bem-estar geral. Quer envelhecer bem? Construa uma reserva muscular e mental com a atividade física. O movimento estimula a síntese proteica e o fator neurotrófico derivado do cérebro, contribuindo para neurogênese e sinaptogênese.
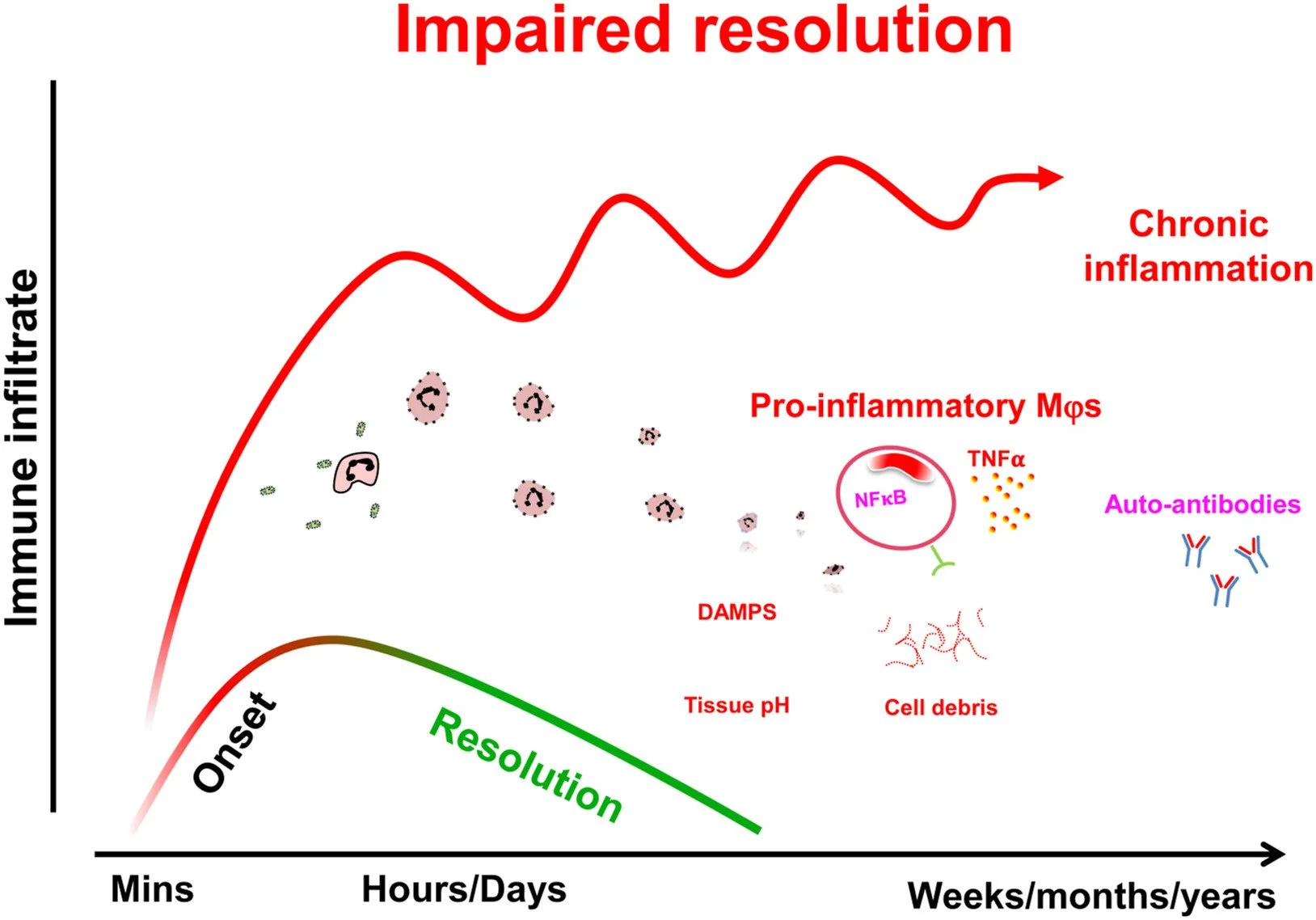
A depressão maior (MDD) está associada a um estado inflamatório crônico de baixo grau (SLGCI). Esse quadro resulta de uma ativação imunológica persistente, muitas vezes desencadeada por fatores do estilo de vida moderno, como sedentarismo, dieta inadequada, sono insuficiente e estresse psicológico.
A prática regular de atividade física tem mostrado modular esses processos inflamatórios e melhorar os sintomas depressivos. O estudo sugere que a falta de atividade física nos dias atuais pode ser um fator importante na prevalência crescente da depressão.
No entanto, é importante destacar que o excesso de exercício também pode ser prejudicial. O overtraining pode levar a sintomas depressivos, indicando que o equilíbrio é fundamental (Carrera-Bastos et al., 2025).
Para alimentar o corpo em movimento e também facilitar a recuperação pós-treino precisamos nos alimentar. O carboidrato é a principal fonte de energia do corpo. Mas muitos conseguem treinar em jejum, com as reservas de glicogênio (carboidrato estocado) ou de gorduras (pela produção de corpos cetônicos).
Por que muitos atletas estão adotando protocolos cetogênicos?
Quando você está em cetose, seu corpo está no modo de queima de gordura principal. Isso significa que, durante o exercício, o corpo aproveitará a gordura corporal armazenada como combustível para o treino.
Pessoas que fazem dieta cetogênica podem queimar até duas vezes mais gordura durante o exercício em comparação àqueles com dietas à base de carboidratos. Assim, quando o objetivo principal é a queima de gordura, a dieta cetogênica pode ser uma grande aliada.
Pessoas que não desejam emagrecer também podem se beneficiar da dieta cetogênica. Para não perder peso, ajuste as calorias e consuma um pouco mais de proteína. Shakes de proteína adicionados de triglicerídeos de cadeia média possuem boa digestibilidade e são uma opção para muitos atletas que gostam de comer antes de treinar.
A quantidade de proteína não deve ser exagerada pois vários aminoácidos podem ser transformados em açúcares tirando o corpo da cetose. Isto não é de todo ruim pois algumas células precisam mesmo de glicose (como os glóbulos vermelhos).
Para saber o que está acontecendo teste seus níveis de cetona ao acordar, antes das refeições e após o treino. Durante a atividade física seu corpo começará a utilizar cetonas, mas se você estiver se exercitando com muita intensidade, seu corpo não terá escolha a não ser começar a tentar utilizar carboidratos como fonte de combustível. Se não tiver estoques de glicogênio e não tiver consumido carboidratos a proteína será convertida em açúcar no processo de gliconeogênese. Assim, a quantidade de cetonas pode cair no pós treino (em cerca de 0,5 milimoles). Não não desespere-se pois os níveis voltam ao normal após uma hora.
Agora, se a variação for maior que 0,5 milimoles ou os níveis não estiverem voltando ao normal o atleta terá quatro opções para manter-se em cetose: (1) reduzir a intensidade do treino ou (2) reduzir calorias ou (3) fazer jejum ou (4) aumentar a ingestão de gordura antes de um treino. Cada pessoa terá que descobrir o que funciona melhor, sem atrapalhar o rendimento no exercício.
Atletas de resistência podem precisar de mais tempo em dieta cetogênica para que o corpo adapte-se. Com o tempo, a intensidade pode voltar a aumentar, sem que o corpo saia da cetose. Mais estudos são necessários nessa área (Bailey, & Hennesy, 2020). -
DIETA CETOGÊNICA PASSO A PASSO (para leigos).
Se você é profissional de saúde entre na plataforma t21.video