A acrilamida (ACR) é um composto químico que apresenta efeitos neurotóxicos e genotóxicos. Causa sintomas neurológicos como tremores, fraqueza geral, dormência, formigamento nos membros ou ataxia. Numerosos estudos científicos demonstram o efeito da ACR nas terminações nervosas e sua estreita ligação com o sistema colinérgico.
O sistema colinérgico faz parte do sistema nervoso autônomo que regula as funções corticais superiores relacionadas à memória, aprendizagem, concentração e atenção. Dentro do sistema colinérgico, existem neurônios colinérgicos, estruturas colinérgicas anatômicas, o neurotransmissor acetilcolina (ACh) e receptores colinérgicos. Alguns relatos científicos sugerem um efeito negativo da ACR no sistema colinérgico e em reações inflamatórias no corpo.
A via anti-inflamatória colinérgica (PAC) é uma via neuroimunomoduladora localizada no sangue e nas membranas mucosas. Seu papel é interromper a resposta inflamatória no momento apropriado. Ela previne a síntese e a liberação de citocinas pró-inflamatórias e, em última análise, regula a resposta imune local e sistêmica.
O mecanismo molecular celular para inibir a síntese de citocinas é atribuído à acetilcolina (ACh), o principal neurotransmissor vagal, e a subunidade do receptor nicotínico α7 (α7nAChR) é um receptor-chave para a via anti-inflamatória colinérgica. A combinação de ACh com α7nAChR resulta na inibição da síntese e liberação de citocinas pró-inflamatórias.
A AChE sanguínea é capaz de interromper a estimulação da via anti-inflamatória colinérgica devido à clivagem da ACh. Consequentemente, a produção de citocinas é essencial para a proteção contra patógenos e o reparo tecidual, mas a liberação excessiva de citocinas pode levar à inflamação sistêmica, falência de órgãos e morte. As respostas inflamatórias são reguladas com precisão para proteger eficazmente contra estímulos nocivos.
O sistema nervoso central interage dinamicamente com o sistema imunológico, modulando a inflamação por meio das vias humoral e nervosa. O aumento dos níveis de acetilcolina (ACh) induzido pelo estresse atua aliviando a resposta inflamatória e restaurando a homeostase. Esse processo de sinalização termina quando a ACh é hidrolisada pela acetilcolinesterase (AChE).
Existem muitos relatos científicos indicando os efeitos nocivos da ACR na AChE. A maioria deles indica que a ACR reduz a concentração e a atividade da AChE. Devido ao efeito neurotóxico da acrilamida, que está relacionado à perturbação da secreção de neurotransmissores, e sua influência na perturbação da atividade da acetilcolinesterase, pode-se concluir que ela perturba a resposta inflamatória normal.
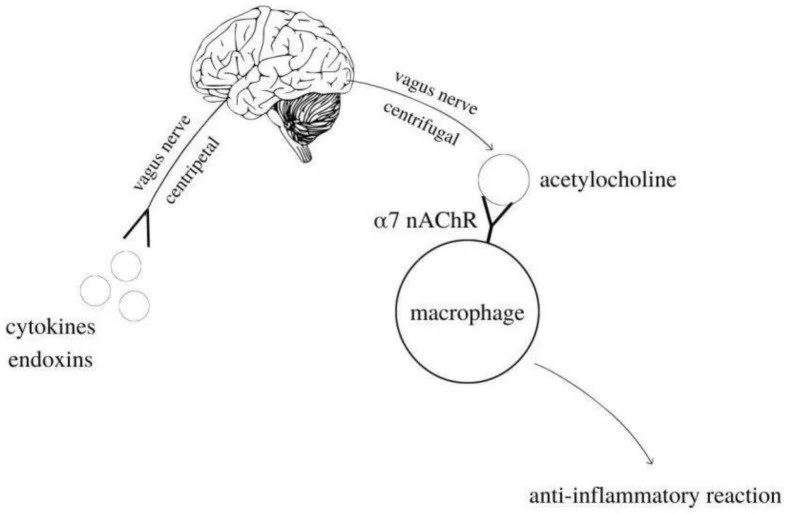
1) O que cada parte da figura representa
Cytokines / endotoxins (citocinas / endotoxinas): Sinais inflamatórios produzidos por células imunes (ex.: TNF-α, IL-1β) ou componentes bacterianos (ex.: LPS). Eles aparecem “na periferia”, onde a inflamação começa.
Vagus nerve – centripetal (aferente): Fibras do nervo vago que sobem para o tronco encefálico levando a mensagem: “há inflamação aqui”.
Cérebro: Núcleos no tronco encefálico (como o núcleo do trato solitário) integram o alerta e disparam a resposta regulatória.
Vagus nerve – centrifugal (eferente)
Fibras do vago que descem levando o comando anti-inflamatório. Esse comando chega a órgãos e gânglios periféricos e envolve também células imunes que produzem acetilcolina.Acetylcholine (ACh): O neurotransmissor “mensageiro” da via. Ele é liberado nas proximidades de células imunes.
Macrophage + α7 nAChR: Macrófagos expressam o receptor nicotínico α7 (α7 nAChR). Quando a ACh se liga a esse receptor, cascatas intracelulares inibem vias pró-inflamatórias (como NF-κB) e reduzem a liberação de citocinas.
Anti-inflammatory reaction: Resultado final: amortecimento da resposta inflamatória sistêmica.
Ou seja, sinais inflamatórios ativam o vago aferente → cérebro → vago eferente → ACh → α7 nAChR em macrófagos → menos citocinas. Este “freio biológico” impede que infecções, traumas ou inflamações crônicas saiam do controle. Intervenções que aumentam o tônus vagal (de estimulação elétrica a estratégias comportamentais) exploram exatamente esse circuito para reduzir inflamação.
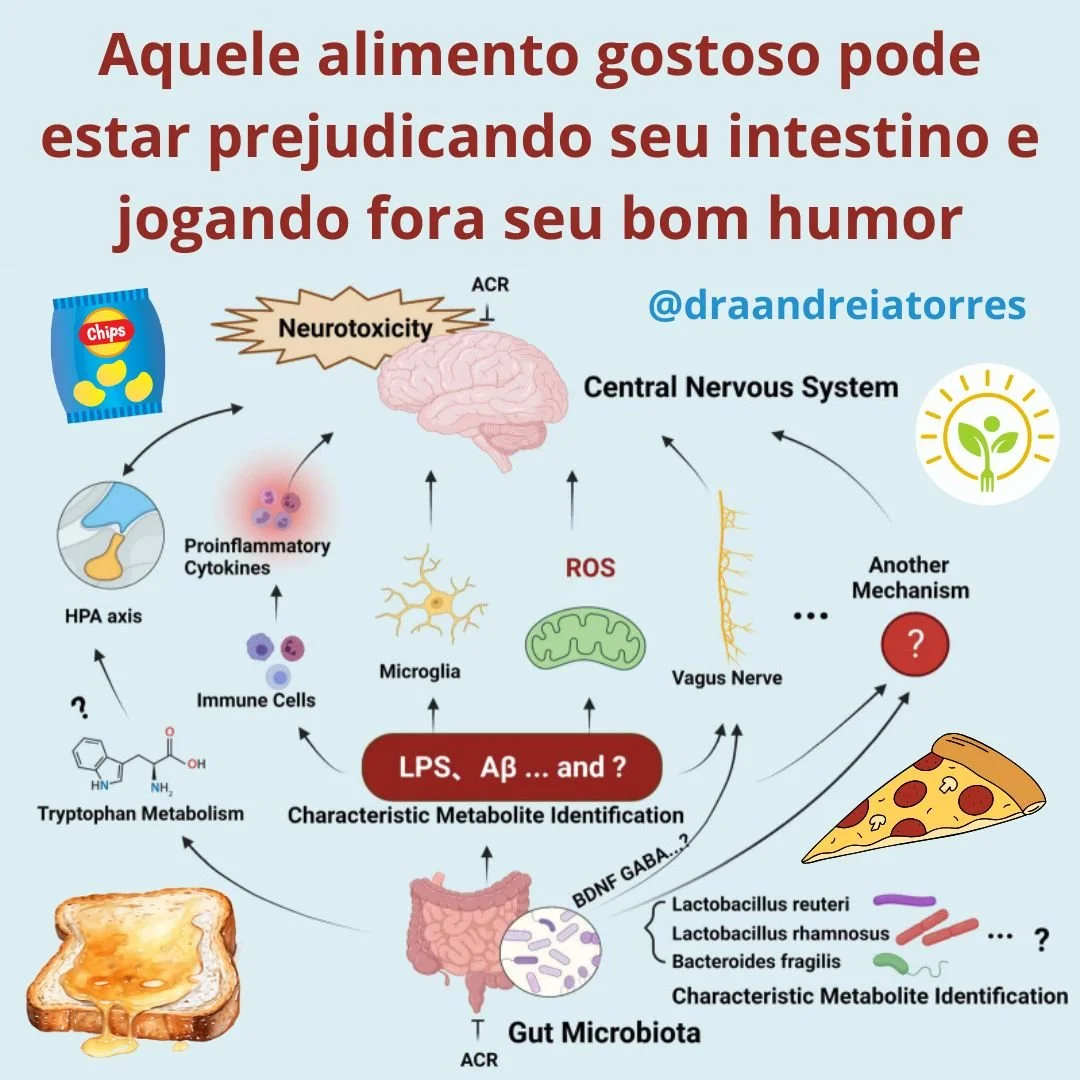
Onde a batata frita (e a acrilamid)a entra na história?
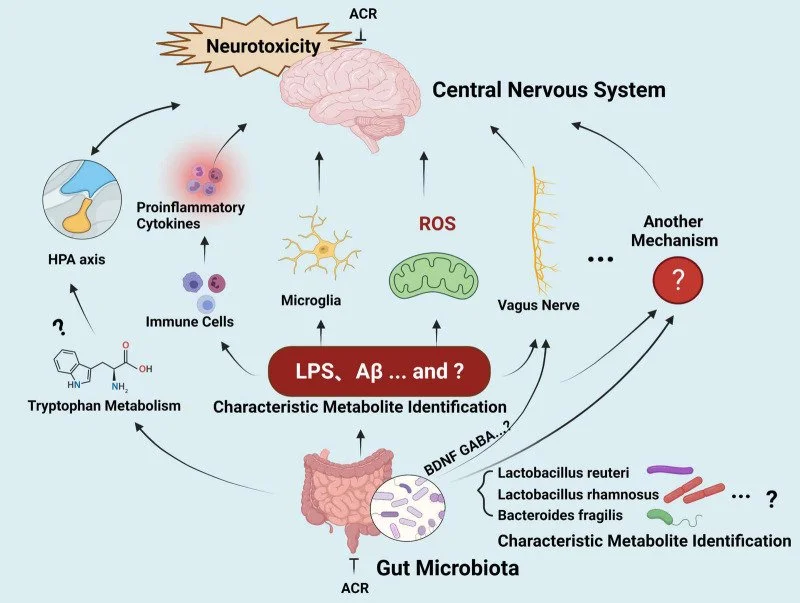
A acrilamida (ACR) é um composto neurotóxico formado, por exemplo, quando alimentos ricos em amido são assados, fritos ou torrados a altas temperaturas. Batata frita, pizza, pãezinhos torrados são ricos em acrilamida. A neurotoxicidade da ACR pode sabotar vários pontos desse diagrama — e é isso que o artigo discute como hipótese para inflamação no sistema colinérgico:
Dano a neurônios vagais e colinérgicos: A ACR causa “axonopatia distal” e disfunção sináptica. Se fibras vagais ou neurônios colinérgicos forem afetados, o sinal eferente que deveria liberar ACh enfraquece, reduzindo o freio anti-inflamatório.
Menor liberação de acetilcolina: A ACR forma adutos com proteínas (especialmente em cisteínas) envolvidas no ciclo vesicular e na maquinaria sináptica. Resultado provável: quanta de ACh menores ou liberação mais errática, novamente “afrouxando” a VCAI.
Estresse oxidativo e microglia reativa: A ACR aumenta espécies reativas de oxigênio e ativa microglia, subindo a maré pró-inflamatória. Quando a maré sobe e o freio colinérgico está fraco, a resposta inflamatória tende a ser mais intensa e prolongada.
Interferência no α7 nAChR (direta ou indireta): Mesmo sem bloquear diretamente o receptor, a ACR pode alterar a expressão/funcionalidade do α7 nAChR por estresse celular e sinalização inflamatória, tornando os macrófagos menos responsivos à ACh.
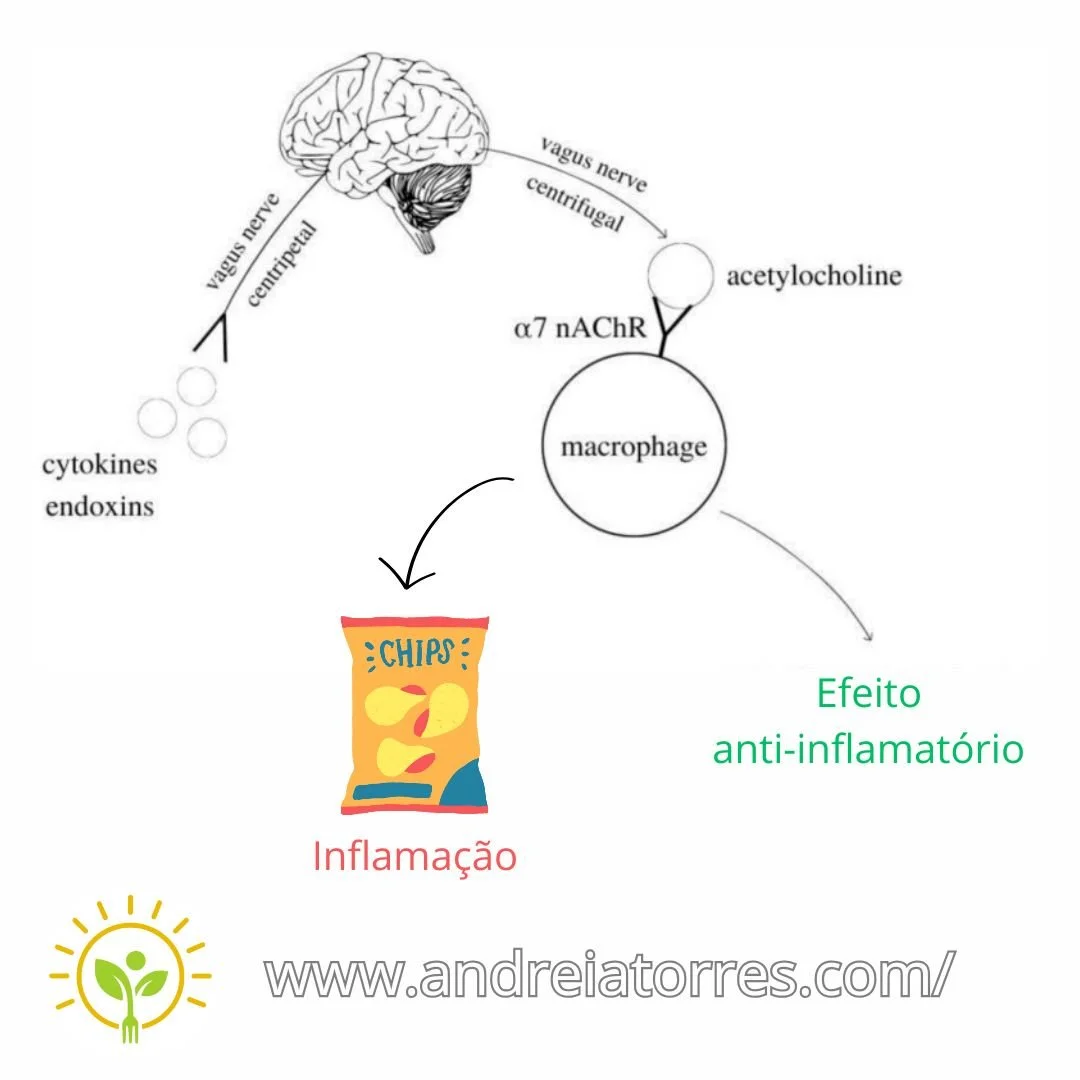
4) O fio lógico completo
Inflamação periférica gera citocinas/endotoxinas →
Vago aferente alerta o cérebro →
Cérebro manda um “contra-comando” via vago eferente →
ACh é liberada e ativa α7 nAChR em macrófagos →
Citocinas caem (ação anti-inflamatória).
Com acrilamida: neurotoxicidade + estresse oxidativo → menos ACh / menor tônus vagal / macrófagos menos sensíveis → freio colinérgico falha → inflamação mais alta e persistente.
5) Implicações práticas (para contextualizar no blog)
A via colinérgica anti-inflamatória é um alvo terapêutico (estimulação do vago, agonistas/positivadores do α7 nAChR).
A exposição crônica à acrilamida pode predispor a um estado inflamatório de baixo grau ao fragilizar esse circuito.
Estratégias de redução de ACR na dieta (modos de preparo mais “brandos”, evitar queimar/torrar alimentos ricos em amido) e de suporte ao tônus vagal (sono, exercícios, respiração diafragmática) fazem sentido dentro desse modelo.
Aprenda mais sobre nutrição e cérebro em https://t21.video