O termo “barreira hemato-humoral” pode ser entendida como uma barreira fisiológica que envolve componentes do sangue e do sistema imunológico (humoral) para proteger tecidos específicos. Geralmente, ele se relaciona com o conceito de barreiras biológicas que regulam a passagem de moléculas e células do sangue para tecidos específicos, evitando danos ou infecções.
Por exemplo:
Barreira hematoencefálica (BHE) – embora chamada de “hematoencefálica”, também poderia ser pensada como hemato-humoral no sentido de controlar a entrada de substâncias do sangue para o cérebro, protegendo-o de toxinas e patógenos.
Barreiras imunológicas humoral – envolvem anticorpos presentes no plasma, proteínas do complemento e citocinas que circulam no sangue, impedindo a disseminação de microrganismos para tecidos sensíveis.
Barreira placentária – limita a passagem de células e certos anticorpos do sangue materno para o feto.
Então, resumindo: a barreira hemato-humoral se refere à proteção de tecidos por mecanismos presentes no sangue (humor), incluindo anticorpos, proteínas do complemento e outras moléculas imunes, que impedem infecções ou substâncias indesejadas de atingirem órgãos críticos.
O sangue contém componentes humoral (anticorpos, proteínas do complemento, citocinas) que podem:
Reconhecer células tumorais como “estranhas”.
Ativar o sistema imunológico para destruir essas células.
Isso é parte da imunovigilância, que é o monitoramento constante do organismo para prevenir que tumores se estabeleçam. Células tumorais muitas vezes desenvolvem mecanismos para driblar essas barreiras, por exemplo:
Secreção de fatores que inibem anticorpos ou células imunes.
Alteração de proteínas de superfície para “passar despercebidas” pelo sistema imune.
Criar um microambiente protetor que impede que células imunes cheguem até elas.
Metástase e barreira hemato-humoral
Quando células tumorais entram na circulação (tornam-se tumores metastáticos):
Elas encontram a barreira hemato-humoral do sangue e anticorpos circulantes.
Apenas células com estratégias de evasão conseguem sobreviver, se fixar em outros órgãos e formar novos tumores.
Compreender essa barreira é crucial para:
Desenvolver imunoterapias (anticorpos monoclonais, vacinas contra tumores).
Melhorar a entrega de drogas quimioterápicas que precisam atravessar essas barreiras.
E a barreira hemato-tumoral?
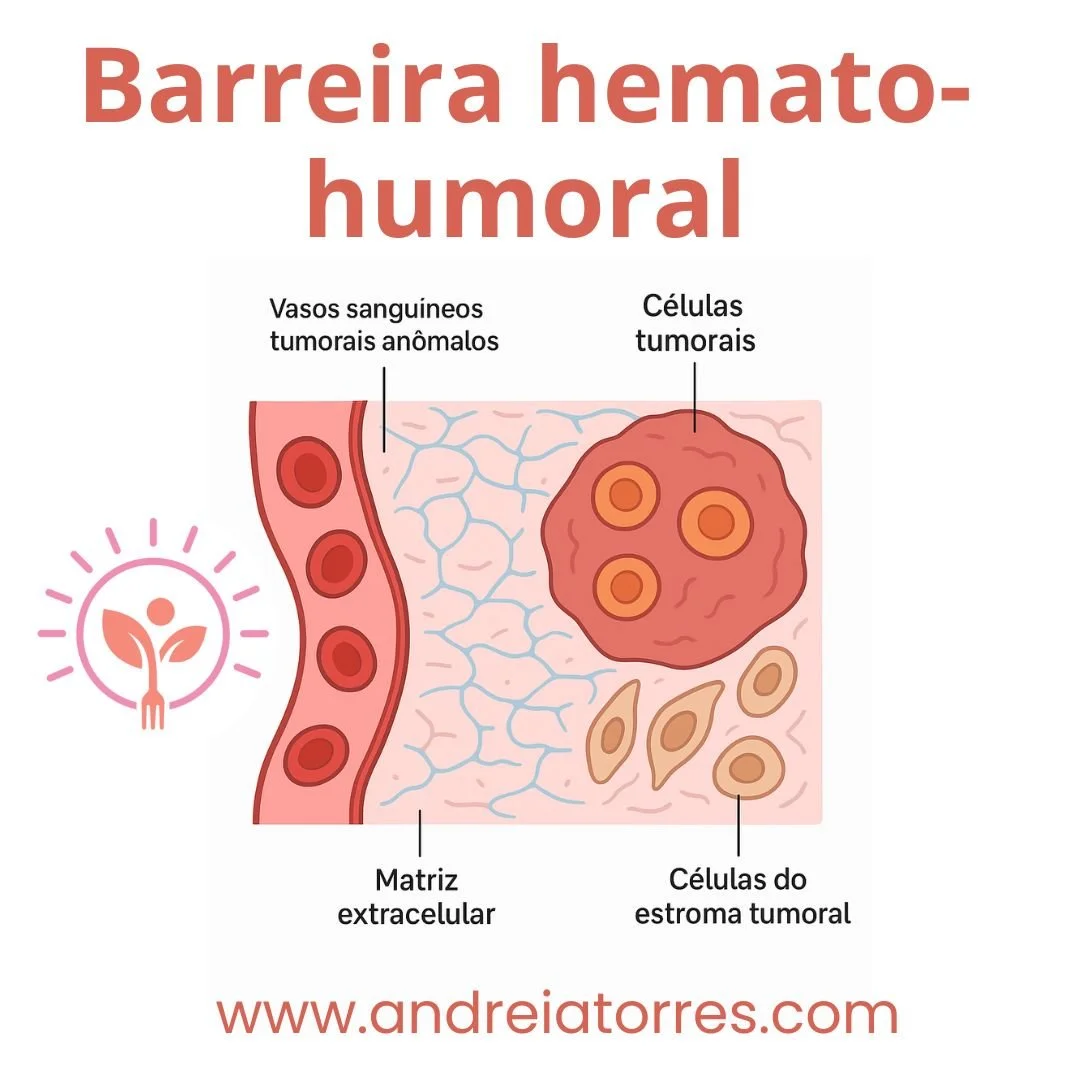
A barreira hemato-tumoral (BHT) é um conceito usado em oncologia para descrever as barreiras fisiológicas e estruturais que dificultam a penetração de células do sistema imune ou de fármacos antineoplásicos no interior de um tumor.
Principais componentes da barreira hemato-tumoral:
Vasos sanguíneos tumorais anômalos
São tortuosos, permeáveis e desorganizados.
Podem ter fluxo irregular, causando regiões hipóxicas e com baixa distribuição de fármacos.
Matriz extracelular (MEC) densa
Rica em colágeno e ácido hialurônico.
Funciona como barreira física para difusão de medicamentos.
Pressão intersticial elevada
O acúmulo de fluido intersticial dentro do tumor dificulta a penetração de moléculas.
Células do estroma tumoral
Fibroblastos associados ao câncer, células endoteliais e células imunes supressoras formam uma barreira biológica, liberando fatores que limitam o acesso terapêutico.
Hipóxia e acidose tumoral
Alteram metabolismo local e podem reduzir eficácia de alguns fármacos.
Impacto clínico:
Quimioterapia: eficácia reduzida, pois a droga não chega uniformemente às células tumorais.
Imunoterapia: infiltração limitada de linfócitos T citotóxicos.
Terapia alvo / nanomedicina: estratégias tentam superar essa barreira (ex.: uso de nanopartículas, agentes que degradam MEC, normalização da vasculatura tumoral).
O papel da nutrição
O microambiente tumoral, que inclui a matriz extracelular densa, hipóxia e acidez, pode ser influenciado por fatores nutricionais. Por exemplo:
Dietas ricas em determinados aminoácidos (como glutamina) podem alterar o metabolismo das células tumorais.
A ingestão de nutrientes antioxidantes pode impactar o estresse oxidativo e a inflamação no microambiente tumoral.
Relevância: A nutrição pode ajudar a modular o microambiente, possivelmente afetando a permeabilidade da BHT e a resposta a terapias.
A pressão elevada e a hipóxia favorecem adaptações metabólicas das células tumorais. Estratégias nutricionais podem auxiliar a manutenção do estado metabólico do paciente, evitando caquexia e perda de massa muscular, que impactam a tolerância à quimioterapia e imunoterapia. Nutrientes como proteínas de alto valor biológico e água ajudam a manter o equilíbrio hídrico e a composição corporal, indiretamente apoiando a distribuição de fármacos.
A barreira hemato-tumoral limita a infiltração de linfócitos T. Uma boa nutrição pode:
Apoiar a função imunológica, aumentando a quantidade e atividade das células imunes circulantes.
Garantir níveis adequados de micronutrientes essenciais (vitaminas A, D, C, zinco, selênio) que participam da resposta imune.
Embora a BHT dificulte a entrada de células T no tumor, pacientes bem nutridos podem ter imunidade mais eficiente, potencialmente ajudando terapias imunológicas.