Diversos estudos têm mostrado maior prevalência de alterações metabólicas em pessoas com depressão resistente: disfunções mitocondriais, alterações no metabolismo de carnitina, folato e metilação.
Dose de folato nos exames
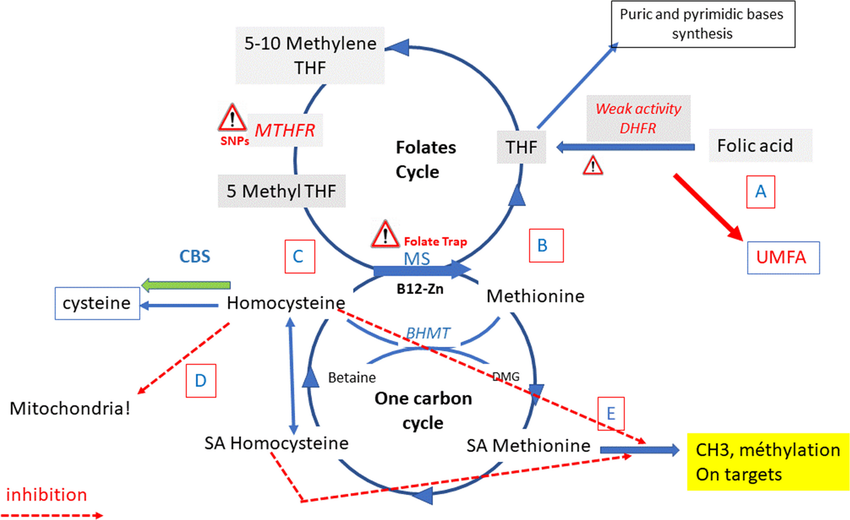
Mas ter folato (vitamina B9) no sangue não é garantia de folato cerebral. No cérebro, a vitamina B9 é fundamental para síntese de neurotransmissores e metilação de DNA. A deficiência no sistema nervoso central pode ocorrer mesmo com níveis séricos normais ou altos (Pan et al., 2023).
Folato sérico vs. folato cerebral
O transporte de folato para o cérebro depende principalmente do transportador FRα (folate receptor alpha) na barreira hematoencefálica (mais especificamente nos plexos coroides).
O que pode ocorrer em alguns pacientes é o chamado “cerebral folate deficiency” (CFD), onde mesmo com níveis séricos adequados de folato, há redução no LCR. Isso pode estar associado a autoanticorpos contra FRα, defeitos genéticos ou competição por transporte.
Excesso de ácido fólico circulante pode atrapalhar o transporte?
O ácido fólico sintético (da dieta fortificada ou suplementos) não é a forma ativa: precisa ser convertido em 5-MTHF (L-metilfolato). Níveis muito altos de ácido fólico não metabolizado no sangue podem competir pelo transportador no plexo coroide. Isso, teoricamente, poderia saturar ou “entupir” o sistema de transporte para o SNC, dificultando a entrada da forma ativa. É a armadilha dos folatos (folate trap).
Esse mecanismo ainda é hipotético, mas alguns estudos sugerem que excesso de ácido fólico sintético pode ser menos eficiente para o cérebro do que suplementar diretamente L-metilfolato (que atravessa mais facilmente a barreira hematoencefálica).
Implicações clínicas
Em depressão resistente, alguns psiquiatras investigam níveis de folato no LCR, embora seja exame invasivo. Na prática, muitas vezes se tenta suplementação com L-metilfolato ou mesmo ácido folínico, justamente para contornar essas barreiras.