O melasma é uma condição de hiperpigmentação crônica e recorrente que atinge principalmente a face, afetando milhões de pessoas ao redor do mundo — com maior prevalência entre mulheres em idade fértil e em regiões tropicais. Ainda que não represente risco direto à saúde, suas manchas escuras têm um impacto significativo na autoestima e no bem-estar emocional.
Mas por que algumas pessoas desenvolvem melasma com facilidade, enquanto outras, mesmo expostas ao sol, não apresentam qualquer alteração? A resposta está além da superfície da pele. Nos últimos anos, estudos avançaram em direção a uma compreensão mais ampla do problema, revelando que a predisposição genética é uma peça-chave nesse quebra-cabeça. 🧬
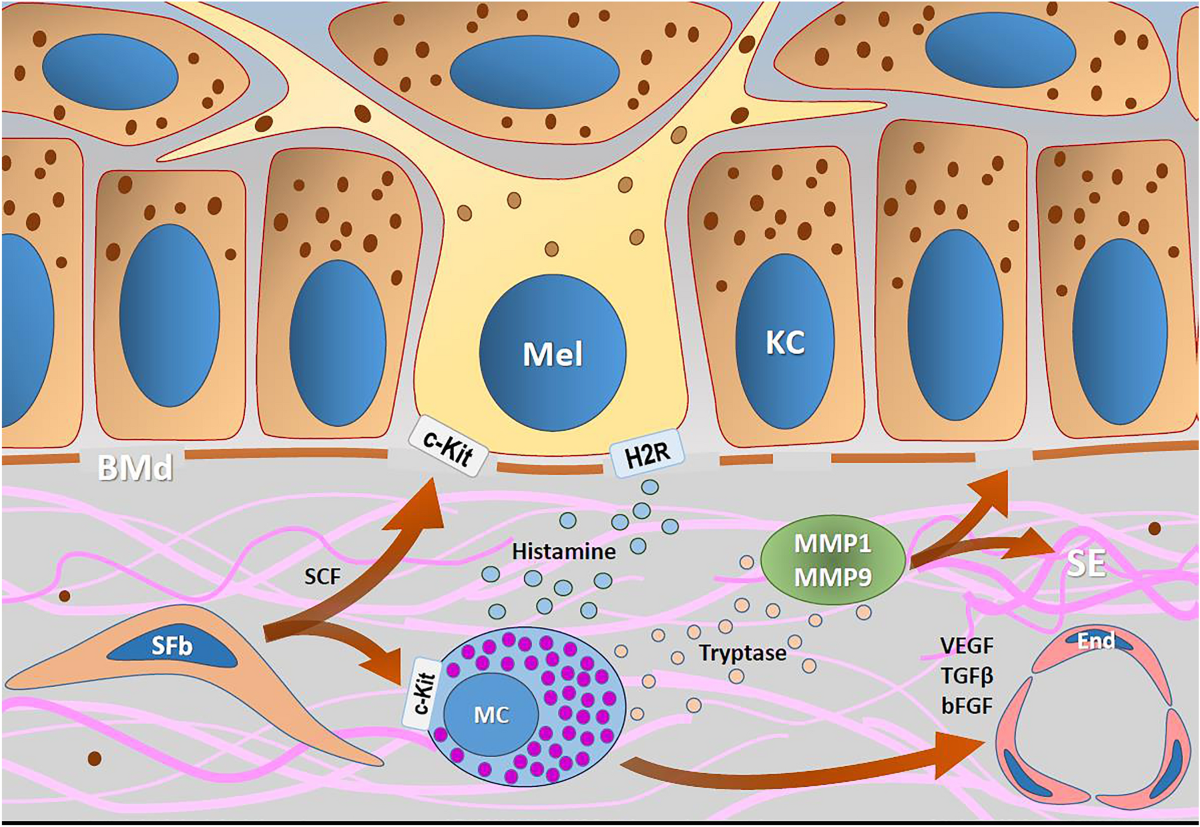
Múltiplos mecanismos envolvidos na patogênese do melasma. UV, Ultravioleta; MITF, fator de transcrição associado à microftalmia; TYR, tirosinase; MC1R, receptor de melanocortina-1; IL-17, interleucina 17; ROS, espécies reativas de oxigênio.
A Influência Genética no Desenvolvimento do Melasma
Enquanto fatores como a radiação solar e alterações hormonais são amplamente reconhecidos como gatilhos do melasma, o artigo de Chen e colaboradores (2024) reforça que a genética molda a suscetibilidade individual à doença. Cerca de 40 a 60% dos pacientes com melasma relatam histórico familiar positivo, indicando que variantes hereditárias desempenham papel relevante.
1. Expressão Alterada de Receptores Hormonais
Estudos demonstram que pacientes com melasma apresentam uma maior expressão de receptores de estrogênio e progesterona na epiderme — resultado, ao que tudo indica, de predisposição genética. Isso faz com que a pele dessas pessoas reaja de forma mais intensa às flutuações hormonais naturais (como na gravidez) ou induzidas (anticoncepcionais, reposição hormonal).
2. Regulação Gênica da Melanogênese
Genes relacionados à produção de melanina (como os que codificam tirosinase, MITF e proteínas envolvidas na via Wnt/β-catenina) também podem sofrer variações que tornam o sistema pigmentário mais ativo ou responsivo a estímulos externos. Essa hiperatividade genética resulta em um maior risco de hiperpigmentação crônica diante de gatilhos ambientais.
3. Participação dos microRNAs
O artigo ainda menciona a crescente importância dos microRNAs — pequenas moléculas que regulam a expressão gênica pós-transcricional. Certos microRNAs estão alterados em pacientes com melasma, modulando negativamente genes de reparo dérmico e intensificando a atividade melanogênica. Como os microRNAs são influenciados por fatores genéticos e ambientais, eles representam um elo entre herança e exposição.
Genética não é destino, mas é ponto de partida
A presença de variantes genéticas associadas ao melasma não garante que a condição vá se manifestar — mas aumenta consideravelmente a sensibilidade da pele aos estímulos. Isso explica por que pessoas com o mesmo nível de exposição solar ou hormonal podem ter reações completamente diferentes.
Compreender o componente genético permite não apenas uma abordagem mais personalizada na prevenção e no tratamento, mas também abre caminho para futuras terapias direcionadas a alvos moleculares específicos.
Fatores de Exposição na Ocorrência e Desenvolvimento do Melasma
1. Radiação Ultravioleta (UV)
A radiação solar é o fator de risco mais importante para o melasma. A exposição a UV-A e UV-B ativa melanócitos, aumentando a expressão de tirosinase e a síntese de melanina. Além disso, os radicais livres induzidos pelo UV e fatores de sinalização como óxido nítrico e Wnt intensificam a pigmentação.
2. Luz Visível (incluindo luz azul)
Embora menos enfatizado, existe evidência crescente de que a luz visível, emitida por telas e LEDs, pode estimular melanócitos, especialmente em peles mais escuras, através de receptores sensíveis na pele. Essa exposição prolonga a atividade pigmentar.
3. Hormônios Sexuais e Endócrinos
Estrogênio e progesterona desempenham papel central. Gravidez, uso de anticoncepcionais hormonais e terapias à base de estrogênio podem disparar ou agravar o melasma. O aumento de receptores hormonais e níveis elevados de E2, FSH e LH foram observados em lesões melásmicas.
Em homens, desequilíbrios como testosterona baixa e LH elevado também foram associados.
Doenças de tireoide: meta-análises mostraram maiores níveis de TSH e anticorpos antitireoidianos em mulheres com melasma, embora o vínculo causal permaneça incerto.
4. Fatores Hepáticos e Nutricionais
Função hepática alterada pode influenciar a melanogênese, já que o fígado sintetiza enzimas-chave. Além disso, a deficiência de zinco – essencial para a função da tireoide – foi registrada em até 46% dos pacientes com melasma, sugerindo um potencial elo nutricional.
5. Genética e Hereditariedade
Histórias familiares são um fator de risco importante. Variantes genéticas podem aumentar a expressão de receptores hormonais, predispondo à hiperpigmentação. Estudos pré-clínicos mostram aumento de receptores de progesterona nas células epidérmicas.
6. Fatores Dermais, Estresse Oxidativo e microRNAs
O artigo destaca novos descobrimentos no nível dérmico:
Estrutura vascular aumentada aumenta aporte de mediadores inflamatórios.
Radicais livres (ROS) e estresse oxidativo colaboram para ativar a melanogênese.
microRNAs regulatórios influenciam genes da pigmentação e reparo da pele PMCspandidos-publications.com.
🛡️ Implicações Preventivas e Terapêuticas
A identificação desses fatores alinha-se a potenciais estratégias:
Uso constante de fotoprotetores de amplo espectro, incluindo proteção contra luz visível.
Avaliação hormonal (estrogênios, tireoide) e condições associadas (p.ex. deficiência de zinco).
Terapias antioxidantes e moduladoras de microRNAs como coadjuvantes emergentes.
Vitamina C: Presente em frutas cítricas, acerola, goiaba, kiwi, pimentão.
Vitamina E: Oleaginosas, sementes, abacate, óleos vegetais.
Betacaroteno (precursor da vitamina A): Cenoura, abóbora, manga, mamão.
Polifenóis: Chá verde, cacau (chocolate amargo), frutas vermelhas, uva roxa
Zinco: Castanhas, sementes de abóbora, carnes magras.
Selênio: Castanha-do-pará (1 a 2 por dia já são suficientes).
Abordagem personalizada considerando genética, rotina solar e histórico hormonal.
Precisa de ajuda? Marque aqui sua consulta de nutrição online
Curso online: Nutrição e estética