Mudança de Comportamento: O Caminho Explicado por Prochaska:
Doença de Alzheimer: o que a ciência sabe até agora sobre suas causas genéticas e celulares
A Doença de Alzheimer (DA) é muito mais do que um simples "esquecimento com a idade". Trata-se de uma doença neurológica crônica e progressiva que afeta milhões de pessoas no mundo todo. Mas afinal, o que causa essa doença? Por que os neurônios morrem? E qual é o papel da genética nisso tudo?
O que acontece no cérebro com Alzheimer?
Na DA, os neurônios — células fundamentais do cérebro — morrem lentamente, prejudicando funções como memória, raciocínio, linguagem e até movimentos.
Isso ocorre por dois motivos principais:
Acúmulo de placas senis, compostas por fragmentos da proteína beta-amiloide (Abeta);
Formação de emaranhados neurofibrilares (NFTs) com a proteína tau hiperfosforilada.
Essas alterações comprometem o funcionamento das células, afetam as mitocôndrias (usinas de energia celular), desregulam o cálcio e iniciam um processo de apoptose — a morte celular programada.
A genética também conta: os genes ligados à Doença de Alzheimer
Cerca de 1 a 5% dos casos de Alzheimer são familiares e têm início precoce (antes dos 65 anos). Estudos revelam quatro genes principais relacionados a essa forma hereditária:
1. APP (proteína precursora do amiloide)
Esse gene está envolvido na produção da beta-amiloide. Mutações no APP podem resultar em fragmentos mais longos e pegajosos da proteína, que se acumulam em placas tóxicas no cérebro. A mutação Val717Ile (V717I) é uma das mais comuns.
2. PSEN1 e PSEN2 (presenilinas 1 e 2)
Esses genes afetam a enzima gama-secretase, responsável por “cortar” a APP. Quando mutados, favorecem a produção do tipo mais tóxico da beta-amiloide, o Abeta42. Mutações como rs28936379 e rs63749851 estão associadas à forma hereditária da doença.
3. APOE (apolipoproteína E)
Especialmente a variante APOE ε4, está fortemente associada ao risco aumentado de Alzheimer de início tardio.
O papel das caspases e da proteína CASP3
Um dos caminhos que levam à morte dos neurônios é a ativação das caspases, enzimas que desencadeiam o processo de apoptose. A CASP3, em especial, é como uma “executora” celular — ela cliva proteínas-chave e ativa outras caspases.
A ativação anormal da CASP3 está associada à morte neuronal em Alzheimer. Além disso, ela está envolvida na clivagem da própria APP, criando ainda mais beta-amiloide.
APP e angiopatia amiloide cerebral: mutações além do Alzheimer
Além da Doença de Alzheimer, algumas mutações no gene APP também causam uma condição chamada angiopatia amiloide cerebral hereditária, que leva a derrames cerebrais e demência.
Veja algumas mutações identificadas:
E22Q (holandesa)
E22K (italiana)
E22G (ártico)
D23N (Iowa)
L34V (Piedmont)
Essas mutações geram formas de beta-amiloide que se acumulam nos vasos sanguíneos, enfraquecendo suas paredes e causando sangramentos no cérebro.
O corpo tenta se defender: o gene NFE2L2
O gene NFE2L2 é um fator de transcrição que ativa a produção de antioxidantes naturais. Ele protege as células dos danos causados pelo estresse oxidativo — que está presente na inflamação e morte celular em Alzheimer.
Por isso, há pesquisas em andamento sobre medicamentos que ativam a via do NFE2L2 como possível estratégia terapêutica para doenças neurodegenerativas.
A ciência tem avançado muito no entendimento da Doença de Alzheimer, especialmente na genética e nos mecanismos celulares envolvidos. Embora ainda não exista cura, esses avanços abrem caminho para diagnósticos mais precoces e terapias personalizadas.
Genes associados com eventos neuropatológicos na DA. Os quatro genes clássicos associados à DA familiar estão na caixa azul, enquanto outros novos genes relacionados à DA esporádica estão nas caixas vermelhas (Andrade-Carrero et al., 2023).
Manter o cérebro ativo, adotar um estilo de vida saudável e, no futuro, realizar testes genéticos poderão ser passos importantes para retardar ou até prevenir o Alzheimer em algumas pessoas. Aprenda mais sobre o cérebro em https://t21.video.
Desvendando o Alzheimer: Como cientistas estão atacando a proteína tau — o "vilão" escondido nos neurônios
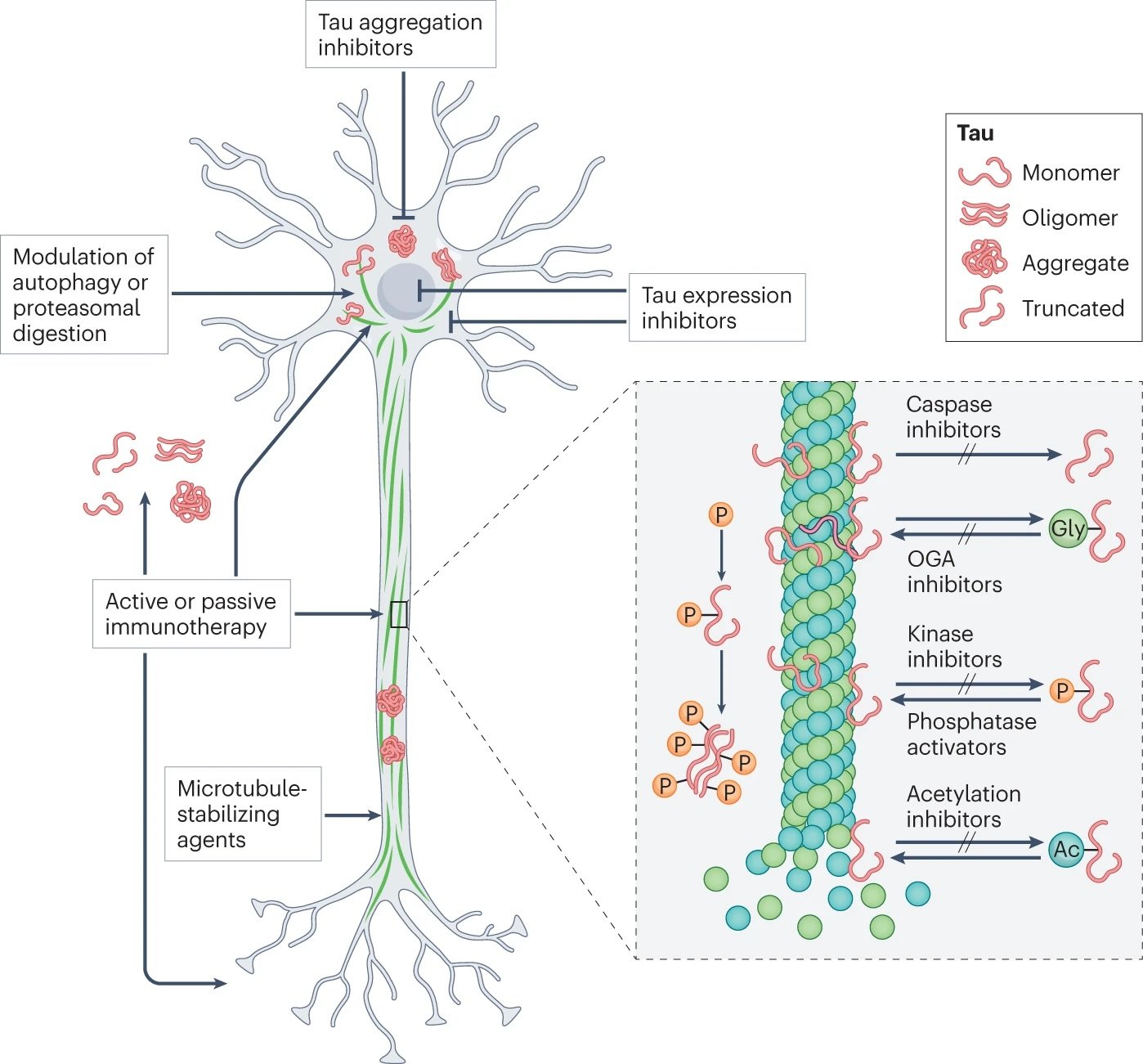
Você já ouviu falar da proteína tau? Para quem está mergulhando no universo do Alzheimer, ela é uma das grandes protagonistas — infelizmente, do lado "vilão". Essa proteína, que normalmente ajuda a manter a estrutura dos neurônios, pode se transformar em um pesadelo quando sofre alterações e se acumula no cérebro.
Mas calma! A ciência está correndo atrás. A imagem acima mostra as estratégias que pesquisadores estão desenvolvendo para combater o Alzheimer atacando diretamente a proteína tau. Vamos destrinchar isso juntos?
Como a tau se transforma em problema?
Na imagem anterior, você vê diferentes formas da tau:
Monômero (forma normal)
Oligômero (quando começa a se agrupar)
Agregado (acúmulo tóxico)
Truncada (forma cortada e ainda mais tóxica)
Essas formas alteradas se espalham pelos neurônios, atrapalhando a comunicação e levando à morte celular.
Frentes de batalha contra a tau
Inibidores de agregação de tau
Evitam que as proteínas se juntem e formem aglomerados tóxicos.Inibidores de expressão de tau
Reduzem a produção da proteína tau nas células.Moduladores de autofagia ou digestão proteossomal
Estimulam o “sistema de reciclagem” celular para destruir tau defeituosa.Imunoterapia (ativa ou passiva)
Usa o sistema imunológico (ou anticorpos artificiais) para reconhecer e remover tau anormal.Agentes estabilizadores de microtúbulos
Reforçam a estrutura dos neurônios, compensando a perda causada pela tau.
Zoom molecular: como regular tau na prática?
No canto direito da imagem, temos um zoom nos microtúbulos (os “trilhos” dos neurônios) mostrando várias formas de impedir que a tau se torne tóxica:
Inibidores de caspase: evitam o corte da tau.
Inibidores de OGA (enzima que remove glicose da tau): regulam sua estabilidade.
Inibidores de quinases / ativadores de fosfatases: controlam a fosforilação (uma modificação que pode deixar a tau disfuncional).
Inibidores de acetilação: evitam alterações químicas que promovem acúmulo da tau.
E o futuro?
Ao atacar a tau por todos os lados — da produção ao descarte — os cientistas estão abrindo novas possibilidades para terapias eficazes, além das já conhecidas para a proteína beta-amiloide.
Ainda há um caminho a percorrer, mas cada uma dessas estratégias é uma peça essencial do quebra-cabeça. E com o avanço da neurociência, estamos mais perto de mudar o curso dessa doença devastadora. Aprenda mais sobre o cérebro em https://t21.video
O que você pode fazer já
Um estilo de vida saudável faz parte dos cuidados com o cérebro. Quando o corpo está saudável o cérebro fica mais saudável também.
1. Prevenção da agregação da proteína tau
Polifenóis e flavonoides: Compostos encontrados em alimentos como chá verde (EGCG), cúrcuma (curcumina), uvas e frutas vermelhas (resveratrol, quercetina) mostram capacidade de inibir a agregação da tau.
Ômega-3 (DHA e EPA): Ácidos graxos presentes em peixes de águas frias auxiliam na manutenção da saúde neuronal e podem reduzir a formação de agregados.
Melatonina: Hormônio natural que tem efeito antioxidante e pode prevenir a agregação da tau em modelos experimentais.
2. Redução da produção excessiva da tau patológica
Dieta balanceada e rica em antioxidantes: Alimentos como frutas, verduras, oleaginosas, e especiarias (ex. açafrão, gengibre) reduzem o estresse oxidativo e a inflamação, fatores que modulam a expressão da tau patológica.
Exercícios físicos regulares: Atividade física melhora a neuroplasticidade e pode reduzir a produção aberrante de tau, por meio da regulação de vias celulares e redução do estresse.
3. Estímulo do descarte e degradação da tau anormal
Ativação do sistema autofágico: A autofagia é uma via celular que degrada proteínas mal dobradas. Compostos naturais como a espermidina (encontrada em vegetais e grãos integrais e em suplemenos) e jejum intermitente podem ativar essa via.
Probióticos e saúde intestinal: A microbiota influencia o sistema imune e pode ajudar no clearance (eliminação) de proteínas tóxicas no cérebro.
Considerações adicionais
Sono de qualidade: O sono ajuda na remoção de toxinas e proteínas acumuladas no cérebro, incluindo a tau.
Redução do estresse crônico: O estresse inflamatório pode aumentar a produção da tau patológica.