O envelhecimento afeta o metabolismo de diversas formas, levando a um declínio na eficiência energética, aumento do estresse oxidativo, resistência à insulina e inflamação crônica. Esses fatores contribuem para o surgimento de doenças como diabetes tipo 2, obesidade, doenças cardiovasculares e neurodegenerativas.
Principais mecanismos pelos quais o envelhecimento impacta o metabolismo
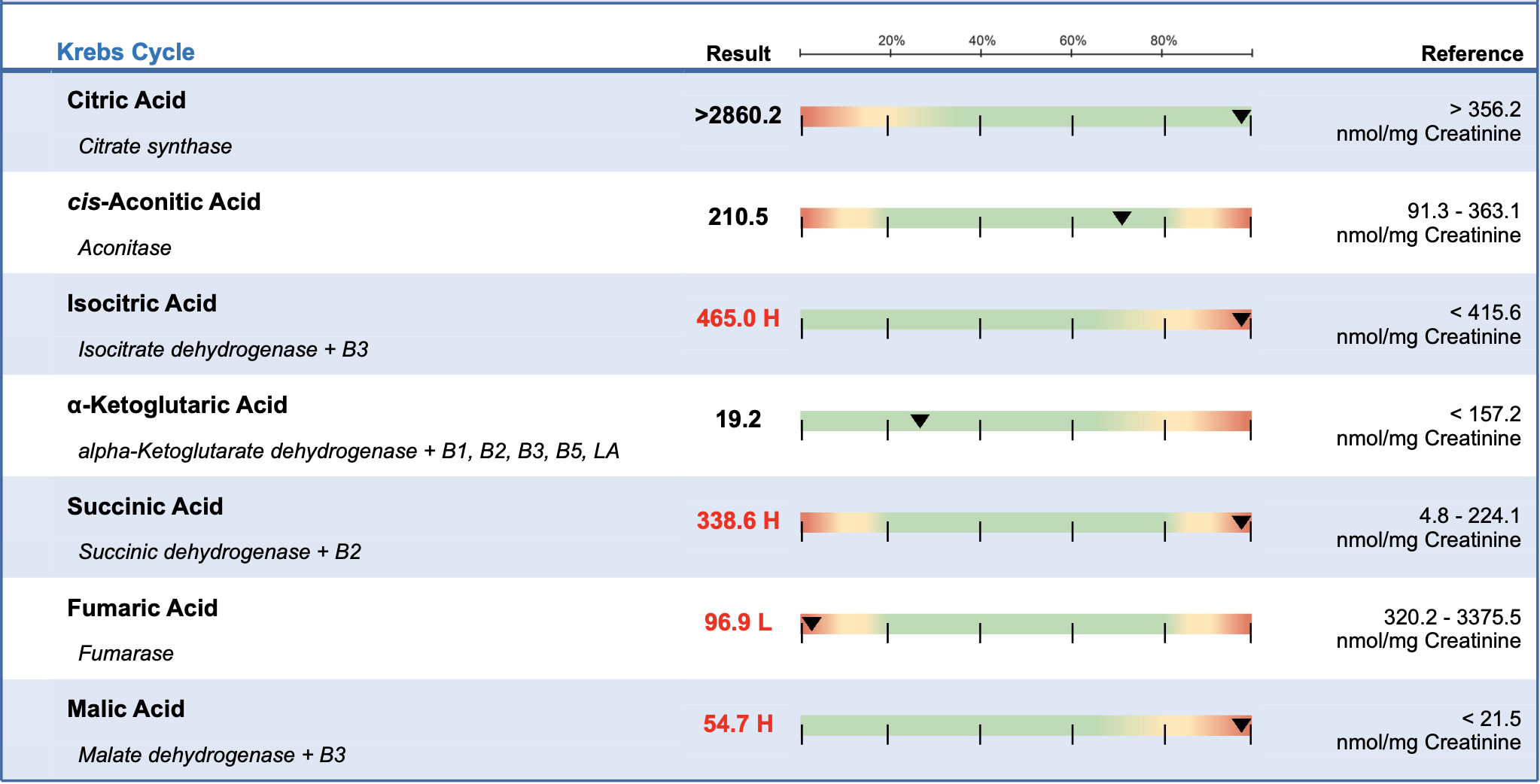
1. Disfunção Mitocondrial e Redução da Produção Energética
As mitocôndrias são as "usinas de energia" da célula, e seu funcionamento se deteriora com o tempo:
Redução da biogênese mitocondrial → Ocorre uma menor produção de novas mitocôndrias devido à diminuição da atividade do PGC-1α (regulador da biogênese mitocondrial).
Danos ao DNA mitocondrial (mtDNA) → A exposição ao estresse oxidativo pode causar mutações no mtDNA, reduzindo a eficiência da produção de ATP.
Menor eficiência na cadeia respiratória → A produção de ATP torna-se menos eficiente, aumentando a geração de radicais livres.
🔹 Consequência: Redução da capacidade de gerar energia, fadiga, menor desempenho físico e aumento do risco de doenças metabólicas.
2. Acúmulo de Radicais Livres e Estresse Oxidativo
Com o envelhecimento, há um desequilíbrio entre a produção de radicais livres e a capacidade do organismo de neutralizá-los:
A produção excessiva de espécies reativas de oxigênio (ROS) danifica lipídios, proteínas e DNA.
A atividade de enzimas antioxidantes como SOD (superóxido dismutase), CAT (catalase) e GPx (glutationa peroxidase) diminui, aumentando o estresse oxidativo.
🔹 Consequência: Maior degradação celular, mutações no DNA, inflamação e desenvolvimento de doenças neurodegenerativas e cardiovasculares.
3. Inflamação Crônica de Baixo Grau ("Inflammaging")
O envelhecimento leva a um estado de inflamação crônica sistêmica sem infecção aparente, conhecido como "inflammaging":
Maior produção de citocinas pró-inflamatórias (IL-6, TNF-α, IL-1β).
Ativação persistente do NF-κB, um regulador da resposta inflamatória.
Disfunção do sistema imunológico inato e adaptativo, aumentando a susceptibilidade a infecções e doenças autoimunes.
🔹 Consequência: Maior risco de resistência à insulina, aterosclerose, sarcopenia e doenças neurodegenerativas como Alzheimer.
4. Resistência à Insulina e Alterações no Metabolismo da Glicose
O envelhecimento compromete a capacidade do corpo de regular a glicose e responder à insulina, levando a:
Redução da sensibilidade dos receptores de insulina, especialmente nos músculos e fígado.
Aumento da produção hepática de glicose, mesmo em estado alimentado.
Acúmulo de gordura visceral, que libera citocinas inflamatórias que pioram a resistência à insulina.
🔹 Consequência: Aumento do risco de diabetes tipo 2, obesidade e síndrome metabólica.
5. Declínio na Autofagia e Acúmulo de Proteínas Mal Dobradas
A autofagia, mecanismo celular de reciclagem e remoção de componentes danificados, diminui com a idade:
Menor ativação do AMPK e do gene FOXO3, que regulam a autofagia.
Acúmulo de proteínas mal dobradas e organelas disfuncionais.
🔹 Consequência: Maior risco de neurodegeneração, como Alzheimer e Parkinson, além de envelhecimento celular acelerado.
6. Alterações na Regulação Epigenética e Metilação do DNA
O envelhecimento leva a mudanças na expressão gênica por meio de alterações epigenéticas:
Hipometilação global do DNA, levando à ativação de genes inflamatórios e ao aumento da instabilidade genômica.
Hipermetilação localizada pode silenciar genes protetores contra o envelhecimento.
🔹 Consequência: Disfunção celular progressiva e aumento do risco de câncer e doenças metabólicas.
7. Alterações na Composição da Microbiota Intestinal
A microbiota intestinal muda com a idade, afetando a absorção de nutrientes e a inflamação:
Redução da diversidade de bactérias benéficas (ex: Bifidobacterium).
Aumento de bactérias pró-inflamatórias, que produzem endotoxinas e ativam a inflamação sistêmica.
🔹 Consequência: Piora da digestão, aumento da inflamação e impacto na saúde metabólica e imunológica.
Alterações metabólicas e transtornos mentais
Os fatores metabólicos associados ao envelhecimento podem aumentar o risco de transtornos mentais como depressão, ansiedade, transtornos neurodegenerativos (Alzheimer, Parkinson) e até esquizofrenia. A conexão entre metabolismo e saúde mental envolve múltiplos mecanismos, incluindo disfunção mitocondrial, inflamação crônica, resistência à insulina e alterações epigenéticas.
1. Disfunção Mitocondrial e Déficit Energético no Cérebro
O cérebro é altamente dependente de energia para manter a função neuronal e a neurotransmissão. Com o envelhecimento, a capacidade das mitocôndrias de gerar ATP diminui, levando a:
Redução da produção de ATP → Menos energia para a manutenção da plasticidade sináptica e cognição.
Aumento do estresse oxidativo → Danos aos neurônios, contribuindo para depressão e doenças neurodegenerativas.
Alteração na neurotransmissão → A baixa produção de energia afeta a síntese de dopamina e serotonina, neurotransmissores essenciais para o humor.
🔹 Consequência: Maior risco de fadiga mental, depressão, ansiedade e neurodegeneração.
2. Inflamação Crônica ("Inflammaging") e Neuroinflamação
A inflamação sistêmica de baixo grau no envelhecimento pode atravessar a barreira hematoencefálica e afetar o cérebro:
Aumento de citocinas pró-inflamatórias (IL-6, TNF-α, IL-1β) prejudica a função neuronal e reduz a neurogênese no hipocampo.
A ativação crônica da microglia (células imunológicas do cérebro) leva à neuroinflamação, contribuindo para ansiedade, depressão e doenças como Alzheimer.
O eixo intestino-cérebro também é afetado, pois bactérias intestinais inflamatórias podem liberar toxinas que alteram a função cerebral.
🔹 Consequência: Inflamação cerebral persistente está associada a depressão resistente ao tratamento, transtornos de ansiedade e declínio cognitivo.
3. Resistência à Insulina e Risco de Doenças Psiquiátricas
A resistência à insulina não afeta apenas o metabolismo periférico, mas também tem impacto direto no cérebro:
O cérebro usa glicose como principal fonte de energia, e a resistência à insulina pode causar hipofunção cerebral.
Estudos mostram que a resistência à insulina afeta neurotransmissores como serotonina e dopamina, aumentando o risco de transtornos do humor.
Pessoas com diabetes tipo 2 e resistência à insulina têm maior incidência de depressão e declínio cognitivo.
🔹 Consequência: Déficits na sinalização da insulina no cérebro estão ligados a depressão, Alzheimer e declínio cognitivo acelerado.
4. Estresse Oxidativo e Neurodegeneração
O estresse oxidativo pode causar danos progressivos ao DNA neuronal, proteínas e lipídios:
Aumento da peroxidação lipídica afeta a membrana neuronal, prejudicando a comunicação entre neurônios.
Oxidação de proteínas leva à formação de placas beta-amiloides (Alzheimer) e agregados de alfa-sinucleína (Parkinson).
A degradação de neurotransmissores por estresse oxidativo pode levar a sintomas de depressão, ansiedade e esquizofrenia.
🔹 Consequência: O aumento do estresse oxidativo pode acelerar o declínio cognitivo e transtornos psiquiátricos.
5. Alterações Epigenéticas e Risco de Depressão e Ansiedade
O envelhecimento leva a mudanças na expressão genética que afetam o cérebro:
Hipometilação global do DNA → Ativação de genes inflamatórios que podem aumentar o risco de depressão e ansiedade.
Hipermetilação de genes neuroprotetores → Pode reduzir a expressão de genes essenciais para a neuroplasticidade e o equilíbrio emocional.
Fatores como dieta, exercício e estresse podem modular essas mudanças epigenéticas, afetando a predisposição a doenças mentais.
🔹 Consequência: A epigenética pode explicar por que algumas pessoas envelhecem com boa saúde mental enquanto outras desenvolvem transtornos psiquiátricos.
6. Disbiose Intestinal e o Eixo Intestino-Cérebro
A microbiota intestinal regula neurotransmissores e a inflamação sistêmica. Com o envelhecimento:
A redução de bactérias benéficas (Bifidobacterium, Lactobacillus) está associada a maior risco de depressão e ansiedade.
O aumento de bactérias inflamatórias pode elevar a produção de endotoxinas, que ativam a inflamação e afetam a função cerebral.
A microbiota influencia a produção de serotonina e GABA, neurotransmissores essenciais para a regulação do humor.
🔹 Consequência: Um intestino inflamado pode contribuir para ansiedade, depressão e declínio cognitivo.
Conclusão
Os processos metabólicos que ocorrem no envelhecimento afetam diretamente o cérebro, aumentando o risco de doenças mentais como depressão, ansiedade, Alzheimer e Parkinson. Estratégias como nutrição adequada, exercício físico, suplementação de cofatores da metilação (B12, folato), antioxidantes e regulação do eixo intestino-cérebro podem ajudar a reduzir esses impactos.