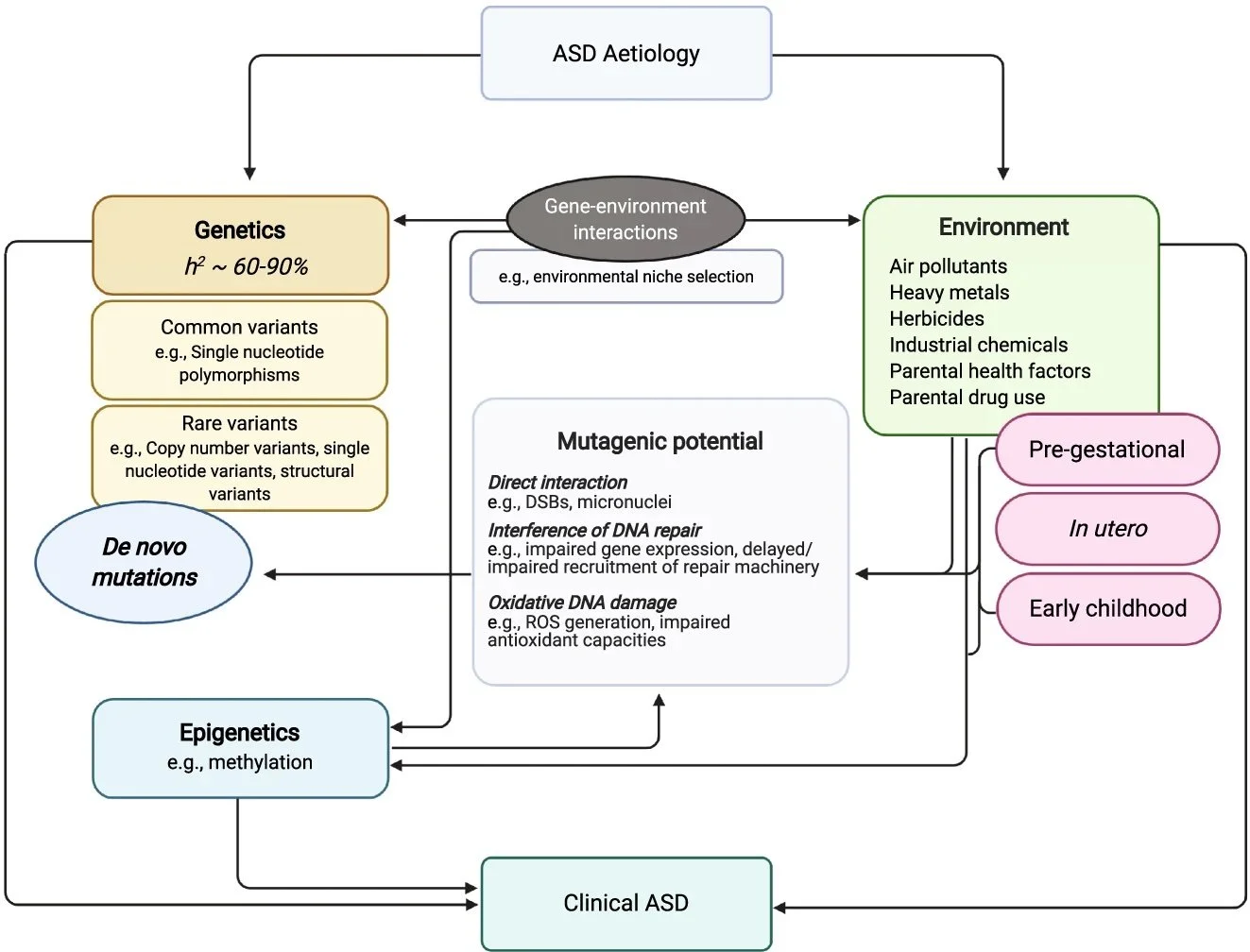
O transtorno do espectro do autismo (TEA) afeta cerca de 1 a 2% da população global. O fenótipo comportamental do transtorno é complexo, variado, mas caracteriza-se principalmente por disfunção na reciprocidade sócio-comunicativa e inflexibilidade comportamental, resultando em dificuldades em uma variedade de contextos interpessoais, acadêmicos e ocupacionais.
Existe um risco maior de TEA entre parentes de primeiro grau daqueles já diagnosticados. A hereditariedade é forte e existe uma concordância de TEA em gêmeos monozigóticos superior a 60-90%. A arquitetura genética do distúrbio consiste na presença de mutações raras (5 a 10% dos casos), anormalidades cromossômicas e polimorfismos de nucleotídeo único.
Além disso, pessoas com TEA parecem mais vulneráveis geneticamente a novas mutações (mutações de novo). Cerca de 5 a 15% dos indivíduos com TEA possuem mutações de novo associadas ao risco. Uma das hipóteses é que pessoas com TEA são mais sujeitas a sofrerem mutações ao entrarem em contato com toxinas ambientais.
Outros fatores ambientais que aumentam o risco de TEA são a idade avançada dos pais no momento da concepção (acúmulo de danos no DNA de gametas), uso de medicamentos (como valproato), exposição à toxinas ou infecções durante a gestação, obesidade ou diabetes materno.
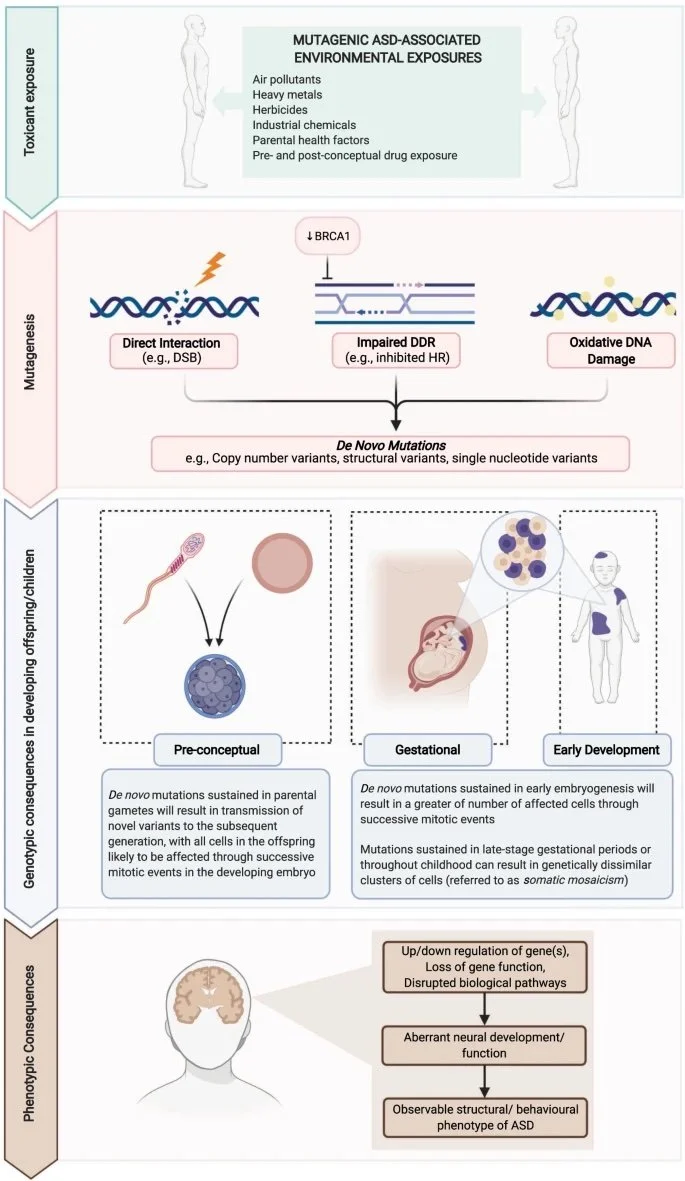
Toxinas, como metais pesados (como chumbo e mercúrio), ftalatos, estireno, herbicidas, inseticidas (como clorpirifós) drogas e poluentes do ar (benzeno e butadieno, componentes do petróleo), podem gerar mutações por três mecanismos principais: (1) interação directa com o material genético, tanto a nível nucleico como cromossômico; (2) interferência no reparo do DNA; e (3) danos indiretos ao DNA provocados pelo estresse oxidativo induzido. Cada um desses processos tem a capacidade de provocar anormalidades genotípicas em sistemas biológicos e são, portanto, importantes a serem considerados em relação à carga mutacional de novo do TEA.
Se os danos ocorrem pré-gestacionalmente nos gametas maternos ou paternos, ou nos estágios iniciais da embriogênese, é plausível que isso pudesse levar à apresentação de uma nova variação genômica na prole que está ausente em qualquer genoma parental. Como a mutação foi em célula germinativa, neste caso, as mutações podem ser transmitidas aos descendentes na geração subsequente.
A prole também pode adquirir mutações em estágios posteriores de desenvolvimento, resultando em mosaicismo somático. Mosaicismo é uma condição genética definida pela presença de duas ou mais linhagens genéticas. Mosaicismo somático acontece em células somáticas, responsáveis por formar tecidos e órgãos. Estas mutações não são transmitidas entre gerações.
Micronúcleos já são mutações a nível cromossômico. A fragmentação do cromossomo gera a formação de um pequeno núcleo ao lado do núcleo original da célula. Embora potencialmente menos deletérios do que perdas ou ganhos cromossômicos inteiros, os micronúcleos são importantes anomalias estruturais indicativas de instabilidade genômica e reparo incorreto de danos em células expostas a toxinas.
Muitos mecanismos moleculares podem gerar a formação de micronúcleos como estresse oxidativo, inflamação, inibição de reparo de DNA, alterações na metilação do DNA ou acetilação de histonas, gerando encurtamento de telômeros, danos ao material genético…
Por exemplo, pessoas expostas à materiais particulados do diesel, cloreto de vinil em fábricas de plásticos, possuem maior incidência de micronúcleos celulares e maior risco de um filho com TEA. Isto porque fragmentos compartimentados de DNA danificado dentro dessas estruturas são vulneráveis à aquisição de mutações. Micronúcleos frequentemente abrigam uma série de rearranjos genômicos, incluindo indels, translocações cromossômicas e variação do número de cópias em sequências codificadoras de genes.
Toxinas também interferem na capacidade de reparo do DNA. Quando há supressão de genes cujos produtos são necessários para detectar, extirpar ou alterar lesões na estrutura de nucleotídeos, o risco de mutações e TEA após exposição a substâncias tóxicas é maior.
Um dos problemas gerados pelo contato com toxinas é o estresse oxidativo, pela maior geração de espécies reativas de oxigênio (ROS), que podem provocar dano ao DNA. O radical hidroxila (•OH) é altamente reativo, forma ligações duplas com bases na estrutura nucleica e abstrai átomos de hidrogênio das ligações da desoxirribose e dos grupos metil dos nucleotídeos da timina. Isto pode provocar várias alterações genômicas.
O dano ao DNA pode ser avaliado pelo marcador urinário 8-OHdG (8-hidroxi-2'-desoxiguanosina ou 8-OHdG). Para neutralizar as consequências patológicas do estresse oxidativo induzido pelo ambiente, o sistema biológico depende de um complexo conjunto de mecanismos de defesa antioxidante endógenos e exógenos. Estes incluem enzimas antioxidantes metabólicas (por exemplo, glutationa peroxidase, catalase, superóxido dismutase), proteínas não enzimáticas (por exemplo, lactoferrina) e eliminadores de radicais livres (por exemplo, ferro).
Deficiências antioxidantes ou a interrupção de suas funções endógenas podem contribuir indiretamente para a aquisição de lesões genômicas, se sustentadas ao longo do tempo. A suplementação multivitamínica materna durante a gravidez protege contra danos oxidativos ao DNA e reduz a incidência de TEA. Já as carências nutricionais (especialmente de vitamina D e folato) e o contato com toxinas como formaldeído até medicamentos (paracetamol e antidepressivos) perturbam o status antioxidante em células gametais e somáticas, potencializando desequilíbrios oxidativos e danos ao DNA induzidos por ROS em tecidos afetados.
Mutações podem ser adquiridas em qualquer estágio da vida
Embora mutações anteriores ou no início da embriogênese provoquem um número maior de células que abrigam anomalias genéticas, mutações induzidas pela exposição em períodos posteriores de a gravidez ou a infância também podem perturbar o neurodesenvolvimento. Quando o mosaicismo somático atinge células neurais, pode haver interrupção de genes centrais aos processos de proliferação, sinaptogênese ou poda sináptica, resultando em crescimento neurológico aberrante ou subótimo, uma característica observada do fenótipo do TEA.
Embora h isoladamente, é improvável que estas mutações provoquem o TEA, também não ajudam, podendo aumentar a gravidade e persistência dos sintomas em indivíduos em risco, contribuindo assim para o comprometimento funcional que coincide com o diagnóstico clínico. As consequências fenotípicas dos eventos mutacionais variam dependendo dos genes afetados.
Agentes ambientais e epigenética
Vários toxinas ambientais perturbam mecanismos epigenéticos, particularmente processos de metilação do DNA, em estágios sensíveis ao desenvolvimento de diferenciação, proliferação e migração neural, indicando que essas interações gene-ambiente não genômicas são determinantes importantes no perfil de suscetibilidade do TEA.
Uma limitação importante na caracterização da relação gene-ambiente é a falta de análise nos estudos de cada agente ambiental potencialmente nocivo. Também faltam dados nos estudos sobre a taxa de mutações de novo nas amostras de indivíduos com TEA. A identificação de mutações espontâneas de novo depende da disponibilidade da informação genética de cada mãe, pai e descendência. São estudos ainda muito caros, mas que devem avançar conforme as tecnologias tornam-se mais acessíveis.