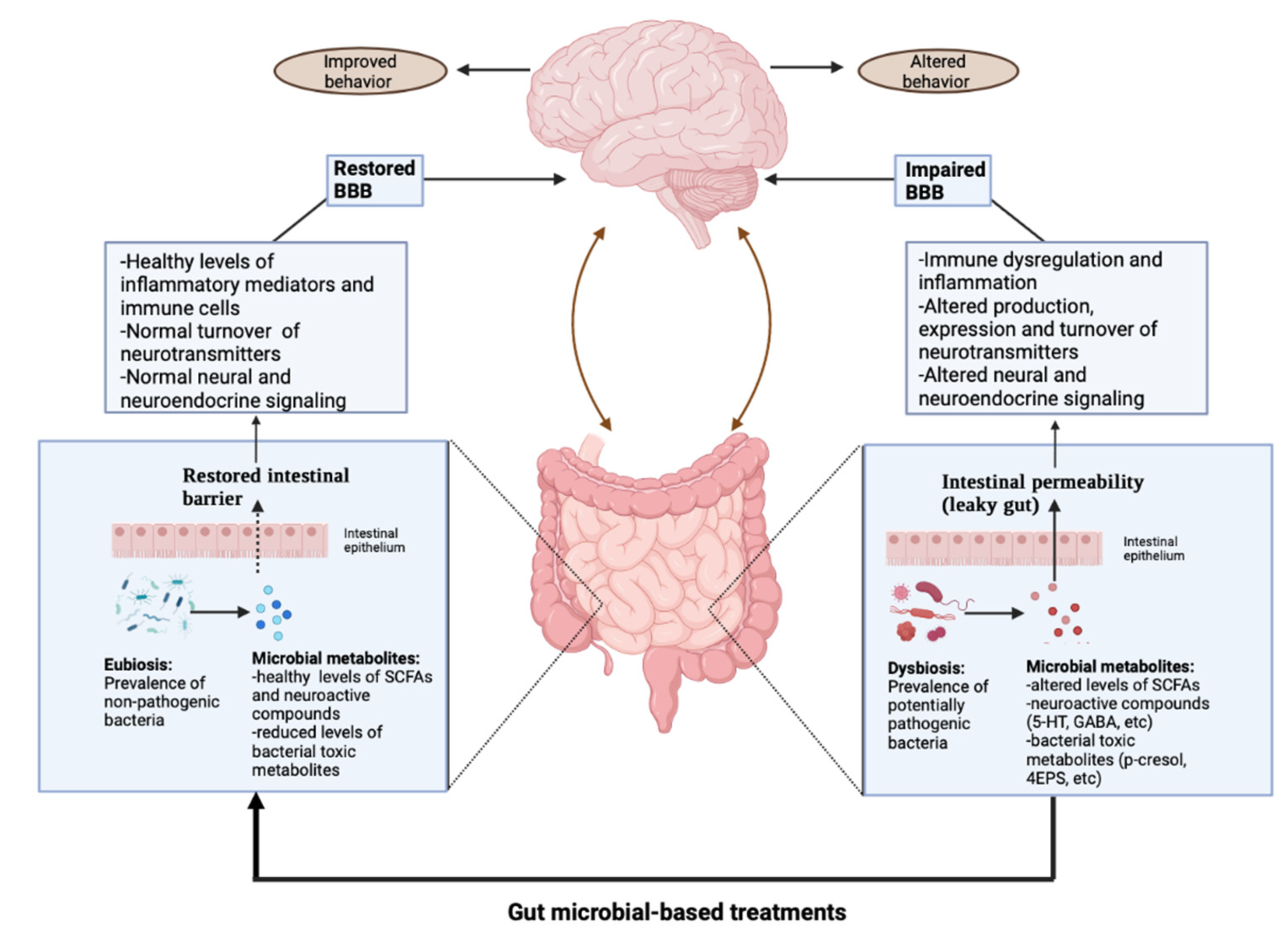
A microbiota intestinal alterada afeta negativamente o neurodesenvolvimento e o comportamento. A ideia de um possível envolvimento da microbiota intestinal no Transtorno do Espectro do Autismo (TEA) foi postulada pela primeira vez em 1998 pelas evidências de que o tratamento do excesso de Clostridium poderia gerar melhorias temporárias nos sintomas comportamentais e gastrointestinais observados.
Bactérias formadoras de esporos podem liberar toxinas pró-inflamatórias e metabólitos potencialmente tóxicos, como derivados de indol, p-cresol e certos fenóis e ácido propiónico que, após atingirem o cérebro através do fluxo sanguíneo, podem afetar o neurodesenvolvimento.
Estas descobertas iniciais, juntamente com a ocorrência frequente de sintomas gastrointestinais no TEA, levaram numerosos investigadores a pesquisar a composição da microbiota intestinal em indivíduos autistas, comparando-a com a de controlos neurotípicos (NT). Observa-se que, indivíduos com TEA e regressão frequentemente apresentam maior colonização por Proteobacteria e Desulfovibrio.
Essas bactérias podem ser contribuintes relevantes para complicações gastrointestinais no TEA, pois produzem LPS e sulfeto de hidrogênio que podem ter efeitos citotóxicos nas células intestinais. Níveis diminuídos de Bifidobacterium e Prevotella, que podem ter efeitos benéficos através de suas propriedades anti-inflamatórias, também têm sido frequentemente relatados no TEA.
Outro gênero bacteriano consideravelmente diminuído é o da Akkermansia, especialmente a espécie Akkermansia muciniphila, cuja redução pode resultar em um aumento relevante na permeabilidade intestinal.
Síndrome fúngica no TEA
Embora a maioria dos estudos sobre a microbiota tenha se concentrado em bactérias, alguns deles também relataram alterações nos componentes fúngicos da microbiota intestinal, especialmente na espécie Candida albicans. A liberação de amônia e toxinas, bem como a absorção reduzida de minerais e carboidratos, devido ao aumento da contagem de Candida, associa-se a comportamentos típicos do autismo.
Apesar destes achados serem frequentes na literatura, existem muitas diferenças entres as pessoas. As discrepâncias nos resultados podem ser atribuídas a diversos motivos, incluindo o número restrito de participantes nos estudos, as diferenças consideráveis nos métodos de amostragem, técnicas analíticas, bases de dados referidas e métodos estatísticos entre os estudos. Os fatores supracitados impactam negativamente na confiabilidade da comparação entre os estudos, sugerindo a necessidade de métodos padronizados de análise.
Além disso, a composição doa microbiota intestinal pode ser significativamente afetada por diferenças geográficas, dietéticas, genéticas, ambientais e culturais. Por estas razões, todos os resultados devem ser considerados com cautela.
Relação intestino-cérebro
O microbioma intestinal pode afetar as atividades cerebrais, tanto direta como indiretamente, através de uma série de conexões neurais, endócrinas e imunológicas. Desde que foi comprovada a influência do microbioma intestinal nas funções cerebrais, foram realizados muitos esforços para explorar o impacto da disbiose nos distúrbios neuropsiquiátricos e nos transtornos do neurodesenvolvimento.
Melhorar a microbiota exige uma modificação na qualidade da dieta e, muitas vezes, a suplementação de pré e probióticos. Os probióticos são definidos como “microrganismos vivos que, quando administrados em quantidades adequadas, conferem um benefício à saúde do hospedeiro” e prebióticos como substratos que são “utilizados seletivamente pelos microrganismos hospedeiros, conferindo um benefício à saúde ”. Prebióticos podem ser fibras ou polifenóis das plantas.
Uma fórmula suplementar baseada em três cepas probióticas, incluindo Lactobacillus acidophilus, Lactobacillus rhamnosus e Bifidobacterium longum, foi administrada a um grupo de crianças com diagnóstico de TEA durante três meses. Melhorias significativas nos sintomas gastrointestinais e principais do TEA foram observadas após o tratamento, bem como uma melhora notável na composição do microbioma intestinal, revelada por um aumento substancial em Bifidobactérias e Lactobacilos.
A De Simone Formulation (DSF), comercializada como Vivomixx® é um suplemento probiótico composto por oito cepas probióticas, principalmente Lactobacilli e Bifidobacteria, incluindo Lactobacillus para-casei, Lactobacillus plantarum, Lactobacillus acidophilus, Lactobacillus delbrueckii subsp. Bulgaricus, Bifidobacterium longum, Bifidobacterium infantis, Bifidobacterium breve e Streptococcus thermophilus.
Em um ensaio duplo-cego randomizado controlado realizado por Santocchi et al., a DSF foi administrada por via oral a um grupo de crianças com TEA na posologia de dois pacotes/dia durante um mês e um pacote/dia durante os cinco meses seguintes. Apenas crianças com sintomas gastrointestinais experimentaram melhorias nas suas queixas gastrointestinais, perfis sensoriais e funcionamento adaptativo após o tratamento.
Em 2020, Wang et al. compararam a composição da microbiota intestinal, os SCFAs fecais e os neurotransmissores plasmáticos de 26 indivíduos autistas com os de 24 controles neurotípicos. Em seguida, eles administraram um grupo de 16 pacientes com TEA com suplementação de probióticos + FOS e outros 10 com suplementação de placebo por 30 a 108 dias. A mistura fornecida ao grupo probióticos+FOS era composta por frutooligossacarídeos e quatro cepas probióticas diferentes, incluindo Bifidobacterium infantis Bi-26, Lactobacillus rhamnosus HN001, Bifidobacterium lactis BL-04 e Lactobacillus paracasei LPC-37.
O perfil da microbiota intestinal revelou uma disbiose significativa em crianças com TEA, com níveis mais elevados de bactérias potencialmente patogênicas, como Clostridium e Ruminococcus, e contagens mais baixas de bactérias benéficas, incluindo Bifidobacteria e especialmente B. longum. Os níveis fecais de AGCC, particularmente ácido propiônico, ácido butírico e ácido acético, foram considerados consideravelmente mais baixos em indivíduos com TEA em comparação com controles neurotípicos, sugerindo uma redução notável na capacidade de fermentação de seu microbioma.
Além disso, os neurotransmissores plasmáticos e os metabólitos relacionados estavam significativamente desequilibrados em indivíduos com TEA, que apresentavam uma condição hiperserotonérgica evidente e distúrbios metabólicos no metabolismo da dopamina e na via triptofano-quinurenina.
Os pacientes em uso de probióticos+FOS mostraram melhorias significativas tanto nos sintomas gastrointestinais quanto nos principais sintomas do TEA, e os efeitos benéficos foram mais proeminentes com o tempo de administração. Em termos da composição do microbioma intestinal, a intervenção probióticos+FOS resultou numa diminuição significativa na abundância relativa de Clostridium e num aumento de B. longum. Os níveis de AGCC melhoraram gradativamente, aproximando-se de valores semelhantes aos do grupo controle, e o mesmo aconteceu com os neurotransmissores plasmáticos e os metabólitos relacionados.
Como parte deste estudo, a zonulina foi usada como marcador de permeabilidade intestinal, e seus níveis plasmáticos foram significativamente mais elevados em indivíduos com TEA em comparação com controles NT no início do estudo. Após a intervenção probióticos+FOS, estes níveis diminuíram, sugerindo que a suplementação empregada também poderia levar a uma melhora do intestino permeável.
Para entender melhor estas questões, a Comissão Europeia tem pressionado por padronizações na pesquisa sobre o microbioma. Melhores estudos também são necessários. Estudos de caso-controle não permitem compreender se a disbiose relatada está ligada ao aparecimento do autismo ou se é apenas uma consequência do TEA.
Mais uma vez, a Comissão Europeia, demonstrando grande atenção a estes aspectos, promoveu a criação de um consórcio internacional, cujo objetivo é investigar longitudinalmente as diferenças na evolução do microbioma em crianças com TEA. O projeto GEMMA acompanhará 600 bebês em risco que nasceram de pais que já tinham um filho com TEA.
A esperança é que a análise da evolução do microbioma intestinal, corrigida para todos os possíveis fatores de confusão (efeitos ambientais, medicamentos tomados, efeitos genéticos, e assim por diante), permitirá que um(s) fator(es) específico(s) seja(m) descrito(s) ( ou alguns) que iniciarão uma cascata de eventos, que eventualmente culminarão no aparecimento da doença. Portanto, os próximos anos serão cruciais e provavelmente abrirão novos horizontes para a compreensão da delicada e complexa relação entre humanos e micróbios.