A esclerose lateral amiotrófica (ELA) é uma doença neurodegenerativa caracterizada pela deterioração dos neurônios motores corticais e da medula espinhal. Vários mecanismos têm sido implicados na patogênese da doença, incluindo disfunção mitocondrial, estresse oxidativo e instabilidade do genoma. Estudos mais recentes mostram que a doença pode se estender para além dos limites do sistema nervoso central, sendo observadas alterações metabólicas a nível sistémico e celular. Já foram descritos mais de 10 mecanismos fisiopatológicos explicativos para a doença:
Mecanismos contribuintes para a esclerose lateral amiotrófica
Defeitos em transportadores
Defeitos em genes associados a metabolismo de RNA
Falhas na proteostase
Problemas no reparo do DNA
Disfunção mitocondrial e estresse oxidativo
Disfunção de oligodendrócitos
Fatores tóxicos e disfunção da micróglia
Distúrbios no citoesqueleto e defeitos no transporte axonal
Defeitos no transporte vesicular
Excitotoxicidade
Como são muitos mecanismos drogas que agem em apenas uma destas questões não conseguem regular e restabelecer o metabolismo. Por isso, suplementos que atuam em todas estas vias são muito importantes.
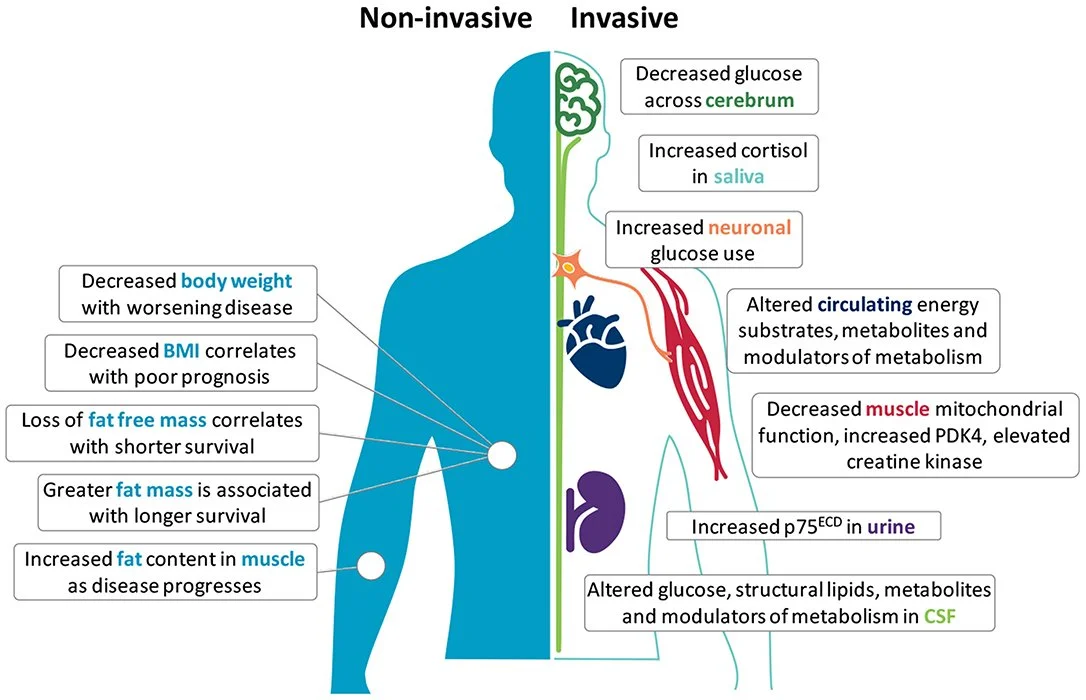
Biomarcadores metabólicos
Cada uma das vias acima é regulada por um conjunto de genes (mostrados na imagem). Por exemplo, polimorfismos dos genes SOD1, TDP-43 estão envolvidos na disfunção mitocondrial. Testes genéticos são muito interessantes para entendermos melhor as variações entre os pacientes.
Infelizmente, não existe um único biomarcador para identificação e controle da doença mas é importante analisar peso, IMC, massa magra, níveis de glicose (no sangue e cérebro por meio de PET-SCAN), cortisol salivar, função mitocondrial. Por exemplo, quanto maior a perda de peso e massa magra, quanto maior o aumento de cortisol e glicemia, pior é o prognóstico do paciente.
Esses biomarcadores fornecem insights mais profundos sobre as repercussões metabólicas da doença em suas múltiplas dimensões. Uma delas é a função mitocondrial. Evidências científicas recentes suportam a existência de regulação negativa ou o recrutamento deficiente de enzimas de reparo de DNA em genomas nucleares e mitocondriais de pessoas com ELA.
Reparo mitocondrial na esclerose lateral amiotrófica
Existem fatores de risco para a esclerose lateral amiotrófica, como comentado anteriormente. Dentre os genes estudados, quatro parecem responsáveis por até 70% de todos os casos de ELA familiar: C9orf72, TARDBP (que codifica TDP-43), SOD1 e FUS. Estes genes geram disfunções metabólicas e mitocondriais.
As mitocôndrias são cruciais para atender às altas demandas de energia do cérebro. Mutações de SOD1 aumentam o estresse oxidativo e comprometem a geração de energia. O comprometimento da homeostase do Ca2+ intracelular também é considerado como um marco da disfunção mitocondrial na neurodegeneração.
O papel das mutações dos genes FUS e TDP-43 também estão envolvidos em danos à função mitocondrial. Esse dano deriva da redução do potencial de membrana mitocondrial e do aumento da produção de radicais livres.
Quando a proteína mutante FUS-P525L se acumula dentro das mitocôndrias, interage com a subunidade catalítica ATP5B da ATP sintase mitocondrial e reduz a síntese de ATP mitocondrial. Da mesma forma, o mutante TDP-43 se acumula nas mitocôndrias dos neurônios em indivíduos com ELA e também demência frontotemporal.
Área 4 de Brodmann (em amarelo)
Estudos mostram que na ELA, os níveis de uma mutação comum de deleção de DNA mitocondrial (mt DNA4977) foram em média mais de 30 vezes na área 4 de Brodmann (córtex motor primário no cérebro, localizado na porção posterior do lobo frontal). Além disso, o dano oxidativo derivado de 8-oxoG foi acumulado nas mitocôndrias de neurônios motores na ELA.
SIRT1 é uma proteína vital na manutenção da homeostase metabólica. Tem papel neuroprotetor e pode ativar o coativador-1α (PGC-1α) do receptor ativado por proliferador de peroxissoma γ (PPARγ) (PGC-1α) através da desacetilação. PGC-1a pode regular genes do sistema de defesa contra radicais livres, por aumento da expressão de genes desintoxicantes de radicais de oxigênio (ROS), incluindo SOD1/SOD2 e UCP2.
SIRT1 também pode desacetilar PGC-1α para induzir a biogênese mitocondrial. Além de seu papel no metabolismo energético mitocondrial, a SIRT1 também é importante no reparo do DNA. A autofagia também é importante para manter o reparo funcional do DNA. A falta de boas opções terapêuticas na ELA mostra a importância de estudarmos mais o metabolismo mitocondrial e tudo que o afeta.
O fato de o dano mitocondrial aparecer no estágio pré-sintomático da doença cria uma oportunidade para atingir as mitocôndrias e, esperançosamente, torna a progressão da doença mais lenta ou até mesmo a interromper. O transplante mitocondrial representa um caminho promissor para os próximos anos, assim como a terapia de repleção de NAD+ e agentes indutores de mitofagia.
Tratamento multidisciplinar é muito importante
A dor é um sintoma comum na ELA e contribui para a deterioração da qualidade de vida e para o aumento da ansiedade e depressão nestes pacientes. Figura: Tipos de dor na esclerose lateral amiotrófica. As causas da dor incluem neuropatia acompanhada de sintomas como queimação, formigamento, dor em pontada. Esses sintomas podem afetar extremidades distais e podem ser focais ou difusos.
As causas secundárias da dor da ELA se desenvolvem à medida que a doença progride. Com a atrofia e fraqueza muscular e a imobilidade prolongada surgem alterações degenerativas no tecido conjuntivo, nos ossos e nas articulações, levando à dor musculoesquelética. As contraturas articulares são comuns e os pacientes com ELA frequentemente experimentam dor no ombro como resultado da perda de força do pescoço e das costas.
Tipos de dor na esclerose lateral amiotrófica. Enquanto alguns pacientes relatam dores leves, outros relatam dores muito severas (Chiò, Mora, & Lauria, 2017)
Existem medicamentos para controle de dores neuropáticas, de dores associadas à contraturas musculares e cãibras, de espasticidade, para dores difusas e parestesias. Para a escolha do melhor medicamento o paciente deve passar por avaliação médica. Além disso, massagens, alongamentos, atividade física moderada, fisioterapia ajudam a trazer alívio para os pacientes. A suplementação adequada para regulação epigenética também é de fundamental importância.