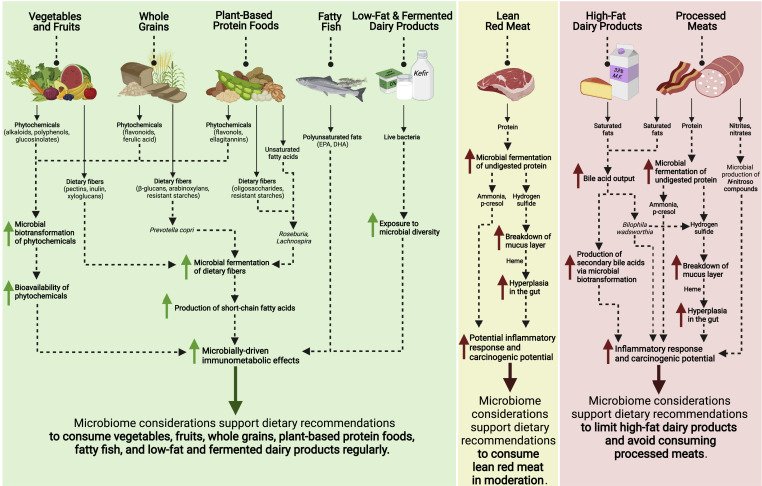
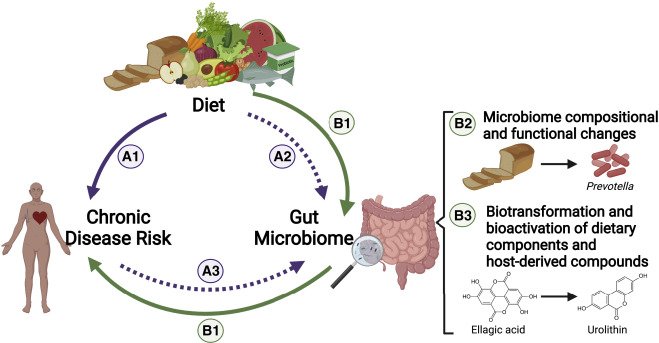
Um intestino que funciona bem é fundamental para o bem-estar físico e mental, para a prevenção do câncer de cólon e também da depressão. Um estudo envolvendo 3.362 adultos com idades entre 18 e 55 anos constatou que indivíduos com depressão apresentavam um risco significativamente maior de constipação. A associação foi mais forte em homens em comparação com mulheres [1].
Outro estudo utilizando dados da Pesquisa Nacional de Exame de Saúde e Nutrição (NHANES) de 2005 a 2010 constatou que a constipação estava significativamente associada à depressão grave [2].
A análise de 4.562 adultos da NHANES de 2009 a 2010 mostrou ainda que a constipação estava associada à depressão de qualquer gravidade (leve, moderada e grave). A associação foi mais forte em homens do que em mulheres [3].
Um estudo de randomização mendeliana bidirecional confirmou uma relação causal entre depressão e constipação crônica. Não foram encontradas evidências de causalidade reversa [4]. Outro estudo utilizando randomização mendeliana constatou que a depressão geneticamente prevista estava associada a um risco aumentado de constipação[5].
Impacto na Qualidade de Vida
A gravidade da depressão intermediou a relação entre a gravidade da constipação e a qualidade de vida relacionada à saúde mental em pacientes constipados. O tratamento da depressão pode melhorar a qualidade de vida desses pacientes [6].
Os estudos demonstram consistentemente uma associação significativa entre constipação e depressão, com a depressão aumentando o risco de constipação. Essa relação é particularmente pronunciada em homens e em diferentes graus de depressão. Recomenda-se o rastreamento regular de depressão em pacientes com constipação para prevenir a deterioração de sua condição.
Referências
1) P Adibi et al. Relationship between Depression and Constipation: Results from a Large Cross-sectional Study in Adults. The Korean journal of gastroenterology = Taehan Sohwagi Hakhoe chi (2022). https://pubmed.ncbi.nlm.nih.gov/36004635/
2) P Wang et al. Association between constipation and major depression in adult Americans: evidence from NHANES 2005-2010. Frontiers in psychiatry (2023). https://pubmed.ncbi.nlm.nih.gov/37654986/
3) Y Wang et al. Constipation is associated with depression of any severity, but not with suicidal ideation: insights from a large cross-sectional study. International journal of colorectal disease (2023). https://pubmed.ncbi.nlm.nih.gov/37713119/
4) Z He et al. Can depression lead to chronic constipation, or does chronic constipation worsen depression? NHANES 2005-2010 and bidirectional mendelian randomization analyses. BMC gastroenterology (2024). https://pubmed.ncbi.nlm.nih.gov/39390366/
5) T Liu et al. Causal relationships between psychological disorders and functional gastrointestinal disorders: a bidirectional two-sample Mendelian randomization study. European journal of gastroenterology & hepatology (2024). https://pubmed.ncbi.nlm.nih.gov/38973539/
6) JJ Albiani et al. Impact of depression and anxiety on the quality of life of constipated patients. Journal of clinical psychology in medical settings (2012). https://pubmed.ncbi.nlm.nih.gov/22581107/