A endometriose (EM) é uma doença inflamatória crônica em que tecido semelhante ao endométrio cresce fora da cavidade uterina, com uma patogênese ainda não totalmente esclarecida.
Macrófagos peritoneais (na cavidade abdominal/peritoneal) têm papel importante no microambiente imunológico da EM, podendo favorecer ou inibir a progressão das lesões dependendo de sua “polarização” (por exemplo, fenótipo M1 pró-inflamatório ou M2 anti-inflamatório/reparador).
Um pesquisa publicada na revista Reproduction investigou o papel do suplemento creatina na modulação desses macrófagos e seu impacto sobre a progressão da endometriose (Chen et al., 2025)
Principais achados
Níveis elevados de creatina em macrófagos peritoneais em pacientes com EM: Os autores observaram que macrófagos peritoneais de mulheres com endometriose apresentam maior enriquecimento e síntese de creatina comparados a mulheres sem a doença. Isso sugere que a creatina pode estar envolvida no ambiente microambiental peritoneal da EM.
Efeito da creatina sobre a polarização de macrófagos (indução de fenótipo M2): Através de experimentos de RNA-seq e ensaios in vitro, foi demonstrado que a creatina “reprograma” os macrófagos peritoneais para um fenótipo M2. Esses macrófagos “M2 induzidos pela creatina” mostram aumento de expressão de metaloproteinases da matriz (que degradam matriz extracelular) e citocinas anti-inflamatórias, fatores que favorecem angiogênese, fibrogênese, adesão celular e reparo tecidual. Ou seja: a creatina altera o comportamento dos macrófagos de modo a favorecer um ambiente “promotor de crescimento” das lesões ectópicas.
Consequências para células do tecido endometrial e para angiogênese/fibrogênese: Quando as células estromais endometriais são co-cultivadas com macrófagos tratados com creatina, essas células demonstram maior migração e maior tendência à fibrogênese. Também foi observada promoção da angiogênese (formação de vasos) em células endoteliais (HUVECs) em presença de macrófagos tratados com creatina. Isso sugere que a reprogramação dos macrófagos por creatina contribui para criar um ambiente favorável ao crescimento, vascularização e “estruturação” das lesões ectópicas.
Implicações da creatina para o desenvolvimento da EM
Com base nos experimentos acima Chen e colaboradores (2025) propõem que a creatina, ao polarizar macrófagos para o fenótipo M2, favorece:
a iniciação das lesões ectópicas;
a formação de fibrose nas lesões (fibrogênese);
a vascularização/angiogênese das lesões ectópicas.
Ou seja: a creatina atua como modulador imunológico que promove a progressão da endometriose.
Limitações do estudo
Embora os resultados do estudo sejam interessantíssimo, os dados são de modelos in vitroou co-culturas, com extrapolação para o ambiente vivo. A complexidade da polarização macrófaga in vivo é alta — há muitos sinais simultâneos no microambiente peritoneal que podem modular essa resposta. Seria importante validar em modelos animais de endometriose (in vivo) e também em amostras humanas adicionais. Assim, outros pontos também devem ser investigados e o uso da metabolômica é bastante útil.
Metabolômica na endometriose
Metabolômica é a ciência que identifica e quantifica todos os metabólitos de um sistema biológico, permitindo compreender as vias metabólicas ativas e suas alterações diante de estímulos fisiológicos, patológicos, ambientais ou genéticos.
Os exames metabolômicos são testes laboratoriais que utilizam técnicas de alta precisão para detectar e medir centenas ou milhares de metabólitos simultaneamente. Eles fornecem uma “assinatura metabólica” do organismo.
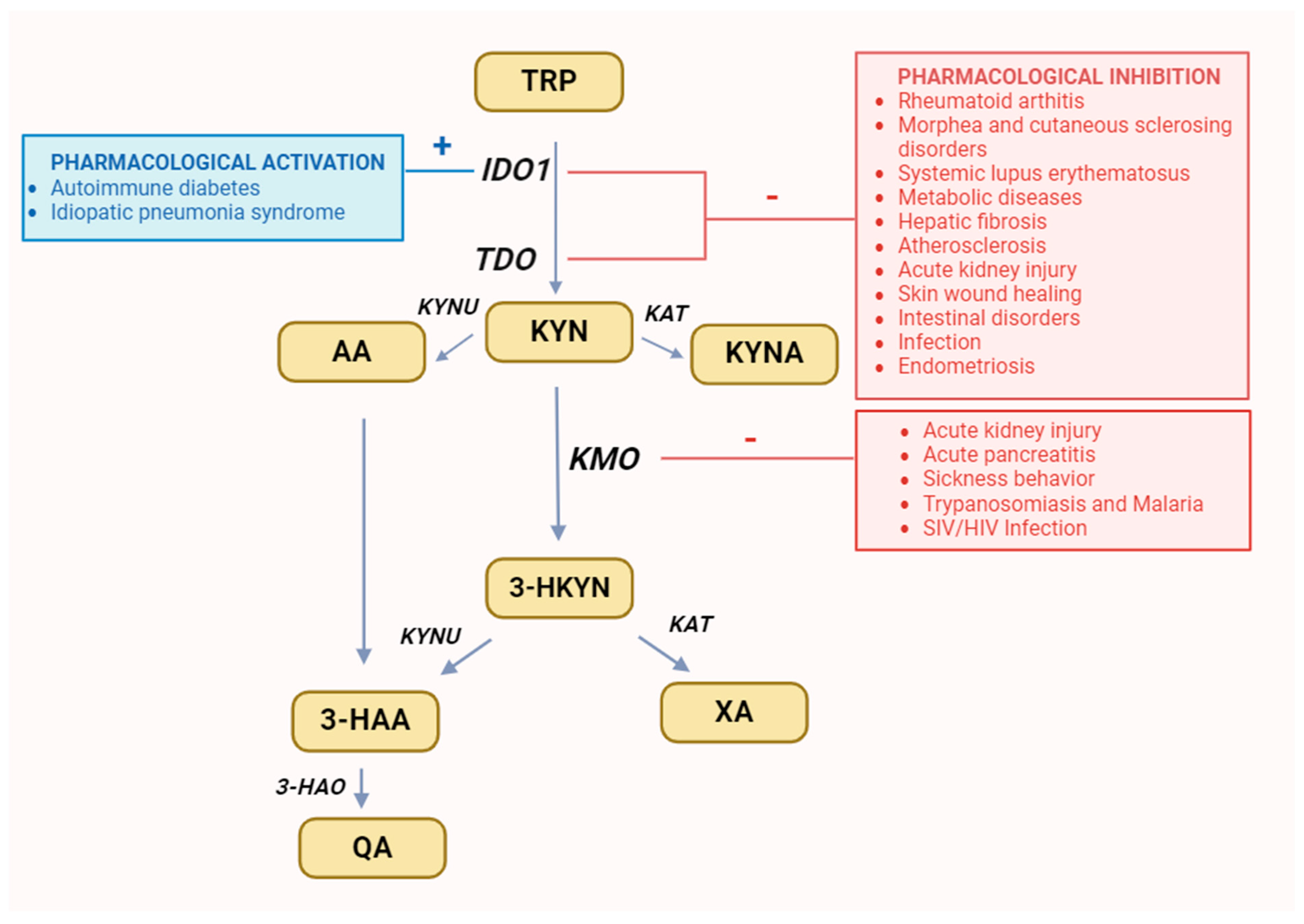
O artigo "Tryptophan and kynurenine stimulate human decidualization via activating Aryl hydrocarbon receptor" de Wang et al. (2020) explora como o triptofano e sua via metabólica, a quinurenina, influenciam a decidualização humana por meio da ativação do receptor aril-hidrocarboneto (AHR).
A decidualização é o processo pelo qual as células estromais do endométrio (o tecido que reveste o útero) sofrem uma transformação estrutural e funcional para se preparar para a possível implantação de um embrião. Esse processo é fundamental para o início e a manutenção da gravidez.
O triptofano é metabolizado pela enzima IDO1 em quinurenina, que ativa o AHR. A sinalização do receptor aril carboneto (AHR) aumenta a expressão de CYP1A1 e CYP1B1, que metabolizam o estradiol em catecolestrogênios (2-hidroxiestradiol e 4-hidroxiestradiol), os quais, por sua vez, induzem a expressão de IGFBP1, promovendo a decidualização.
Receptividade Uterina: A via AHR-kynurenina pode regular a receptividade uterina, essencial para a implantação embrionária.
Distúrbios Reprodutivos: Alterações nessa via podem estar associadas a condições como endometriose e infertilidade.
Terapias Potenciais: Modular a via AHR-kynurenina pode oferecer novas abordagens terapêuticas para distúrbios reprodutivos.
Este estudo destaca a importância da via do triptofano e do AHR na decidualização humana, oferecendo insights para futuras pesquisas e terapias no campo da reprodução.
Implicações para o endométrio
Tolerância imunológica: A kynurenina via AHR pode ajudar a criar um microambiente imunossuprimido local, importante para a implantação embrionária e manutenção da gravidez.
Controle da inflamação: Pode reduzir a ativação de Th17 e produção de IL-17, modulando inflamação endometrial crônica.
Doenças ginecológicas: Alterações nessa via podem estar associadas a condições como endometriose, infertilidade inflamatória ou disfunções do ciclo menstrual.
Interação com CAM: Substâncias que aumentam a kynurenina ou modulam AHR podem ter potencial terapêutico na regulação imunológica do endométrio.
Suplementação
Creatina (monoidrato): evitar suplementação de creatina em pacientes com história de endometriose ou doença ativa. Se paciente já usa creatina (ex.: atletas), discutir riscos/benefícios e considerar interromper até avaliação.
Triptofano / 5-HTP: suplementação pode aumentar disponibilidade de substrato para via Kyn; evitar.
Melatonina, vitamina D, ácidos graxos ômega-3: alguns estudos sugerem efeitos anti-inflamatórios e benefícios na dor pélvica/endometriose — são opções com perfil de segurança melhor documentado; contudo, interações com a via Kyn/AHR são complexas e precisar ser interpretadas caso a caso. Não há evidência direta de que melatonina ou ômega-3 modulam Kyn de forma clinicamente relevante na EM, mas podem ser consideradas como coadjuvantes sintomáticos sob supervisão médica.
Observar gatilhos que aumentam inflamação e ativam a via Kyn: