A deficiência de B12 pode acontecer por vários motivos:
Redução na capacidade de absorção em idosos e pessoas com doenças inflamatórias intestinais (Crohn, colite ulcerativa), doença celíaca, pacientes pós-cirurgia bariátrica
Consumo insuficiente, por dietas restritas em B12
Uso de medicamentos (como metformina, fenformina e inibidores da bomba de prótons)
Infecção por HIV
Anemia perniciosa (investigar anticorpos anti-FI)
Alterações na microbiota intestinal
Polimorfismos genéticos
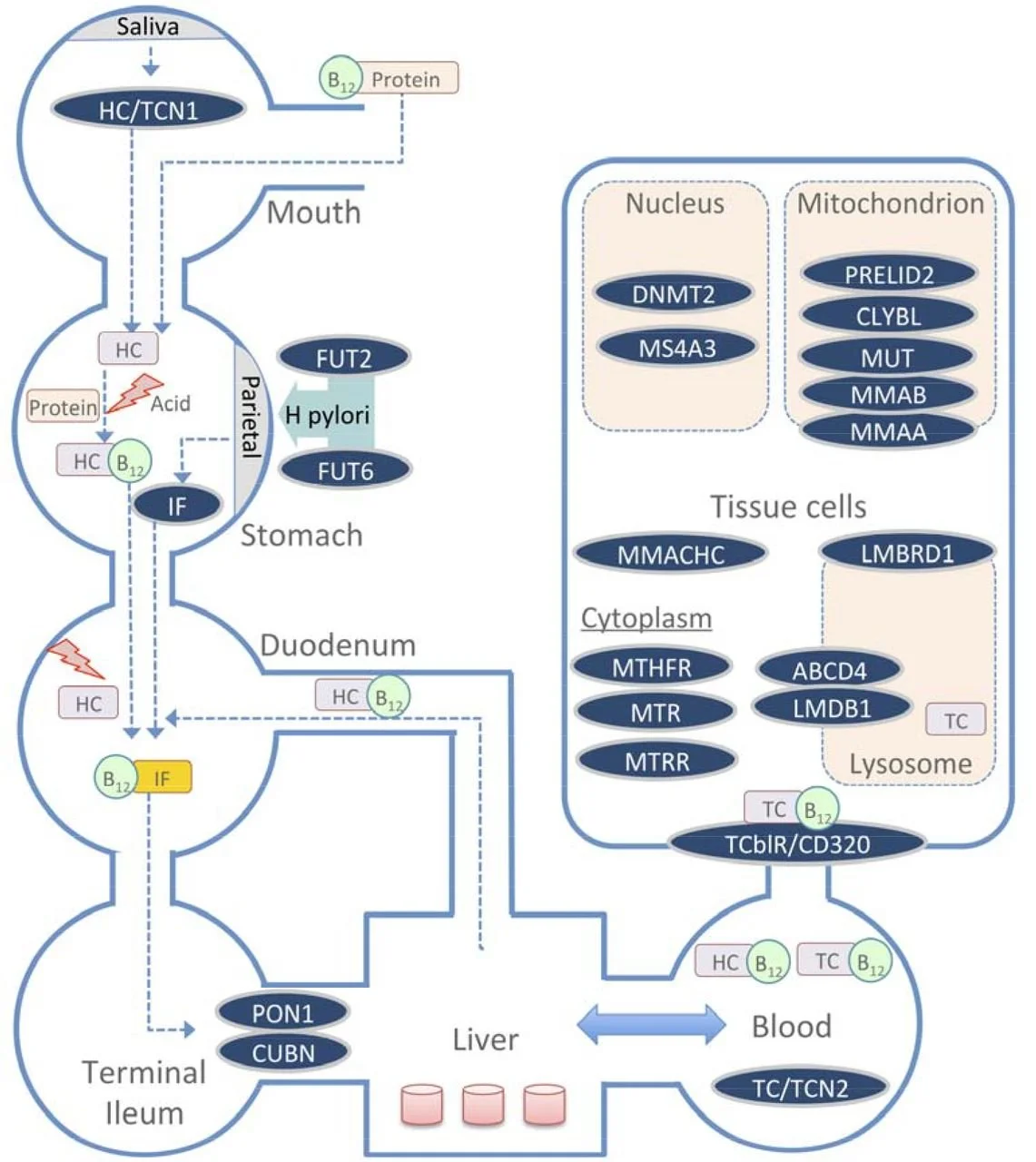
Muitos genes influenciam a absorção e metabolismo da B12. Estes genes aprecem circulados na cor azul na imagem abaixo:
1. Início da digestão (boca e estômago)
Saliva: a vitamina B₁₂ (B₁₂) se liga a proteínas (HC/TCN1, também chamada haptocorrina).
Estômago: As células parietais produzem ácido e o fator intrínseco (IF), essencial para absorção posterior.
Genes envolvidos: FUT2, FUT6 → relacionados a glicosilação e ao microbioma (influenciam infecções como H. pylori, que pode reduzir absorção).
O FUT2 (fucosiltransferase 2) é um dos genes mais estudados em relação à absorção de B12. Codifica uma enzima responsável por adicionar resíduos de fucose a glicanos, formando antígenos do grupo sanguíneo ABO nas secreções e superfícies mucosas. Ele tem relação tanto com o muco intestinal quanto com a absorção de vitamina B12:
O FUT2 determina o status de “secretor” ou “não-secretor”:
Secretores: expressam antígenos ABO nas secreções (muco, saliva, leite materno, etc.). Esses glicanos no muco funcionam como “receptores” e “nutrientes” para a microbiota intestinal.
Não-secretores (FUT2 nulo): não expressam esses antígenos no muco. Indivíduos não-secretores tendem a ter microbiota intestinal diferente (menos Bifidobacterium, por exemplo). Isso influencia barreira mucosa, imunidade e até suscetibilidade a infecções (ex.: norovírus). Indivíduos não-secretores tendem a ter níveis mais baixos de B12. A absorção de B12 no íleo depende do complexo B12–fator intrínseco ligar-se ao receptor cubilina. Acredita-se que isso ocorra porque a alteração no muco e na composição da microbiota afeta a produção, metabolismo ou disponibilidade de B12. Além disso, mudanças nos glicanos podem interferir na interação do fator intrínseco com a mucosa.
rs602662 (GG): tem níveis de B12 muito inferiores aos indivíduos AA.
rs492602 (AA e AG): possuem menores níveis de B12 do que indivíduos GG
rs601338: indivíduos AA tem menor capacidade de fixação de bifidobactéria nas mucosas do trato gastrointestinal, maior tendência à disbiose. Por outro lado, indivíduos GG são mais susceptíveis ao H. pylori, que gera danos à mucosa do estômago e maior interferência na absorção de B12.
2. Duodeno e Íleo terminal
O ácido libera a vitamina B₁₂ ligada às proteínas. A vitamina então se liga ao fator intrínseco (IF) para resistir à degradação.
Genes destacados: PON1, CUBN → participam do transporte do complexo B₁₂-IF através do íleo terminal (absorção intestinal).
CUBN rs11254363: alelo de risco é o A
3. Circulação no sangue
Após ser absorvida, a vitamina B₁₂ circula ligada a duas proteínas:
HC (haptocorrina)
TC/TCN2 (transcobalamina II) → forma biologicamente ativa para entrega aos tecidos.
TCN2 rs1801198: G é o alelo de risco
TC2 rs9606756: G é o alelo de risco
Estas proteínas ligam-se a TCbIR/CD320 → receptor de transcobalamina que permite a entrada da vitamina nas células.
4. Transporte e processamento intracelular
Uma vez dentro da célula, a vitamina B₁₂ passa por vários compartimentos e proteínas para se tornar funcional:
Lisosoma: liberação mediada por LMBD1, LMBRD1, ABCD4.
Citoplasma:
MTR (metionina sintase) e MTRR (metionina sintase redutase) usam a forma metilcobalamina.
MTHFR influencia a regeneração de metilfolato, necessário para a reação da metionina sintase.
Mitocôndria:
MUT (metilmalonil-CoA mutase) usa a forma adenosilcobalamina.
MMAB, MMAA, MMACHC → participam da conversão da B₁₂ em suas formas ativas.
CLYBL, PRELID2 → envolvidos em transporte/metabolismo mitocondrial.
Núcleo: genes regulatórios como DNMT2, MS4A3, relacionados a metilação e regulação epigenética.
5. Armazenamento no fígado
O fígado funciona como reserva principal de vitamina B₁₂, reciclando e redistribuindo conforme necessário. Uma série de outras enzimas podem ser necessárias. Quer aprender mais sobre genética e nutrição? Acesse o curso Genômica nutricional
Alterações no consumo, na saúde dos órgãos ou genéticas podem influenciar os níveis de B12, tornando-os subótimos. Já no caso de aumento exagerado de B12 as causas parecem outras.
B12 pode aumentar muito?
Sim, suplementação exagerada é o principal motivo. Mas B12 também podem aumentar em caso de inflamação ou mesmo câncer. O processo inflamatório estimula os receptores celulares de membrana via Tol/ Like receptor (TLr) desviando a sinalização do IRS ( Insulin receptor substrate ) para via da serina quinase para evitar uma possível acidose metabólica com possível destruição da membrana externa mitocondrial.
Esses mediadores inflamatório aumentam os carreadores Holo Hc, transcobalamina I que carregam uma maior quantidade da vitamina B12 elevando para os níveis para patamares muitas vezes acima de 2000.
Podemos avaliar B12 sérica, Holo TC no plasma, homocisteína, ácido metilmalônico (soro ou urina). Falo destes exames neste outro texto.