A endometriose é uma doença inflamatória crónica caracterizada pela presença de tecido semelhante ao endométrio (revestimento interno do útero) fora da cavidade uterina, geralmente na pelve — incluindo ovários, ligamentos uterinos, peritónio e, em casos menos comuns, intestino, bexiga e outros órgãos. Essas lesões respondem aos estímulos hormonais do ciclo menstrual, levando a inflamação local, dor pélvica, dismenorreia, dispareunia e, frequentemente, infertilidade.
Patogênese
A origem da endometriose é multifatorial e envolve uma complexa interação entre fatores anatómicos, hormonais, imunológicos, genéticos e ambientais:
Teorias clássicas
Menstruação retrógrada (Sampson): o fluxo menstrual reflui pelas trompas de Falópio, depositando células endometriais viáveis na cavidade peritoneal.
Metaplasia celômica: células do peritônio sofrem transformação em tecido semelhante ao endométrio sob estímulos específicos.
Disseminação linfática ou hematogénica: explica lesões em locais distantes.
Eixo hormonal
A doença é estrogénio-dependente. O estrogénio estimula proliferação e sobrevivência das lesões, enquanto a progesterona apresenta resistência funcional nas áreas afetadas, reduzindo efeito anti-inflamatório e antiproliferativo.
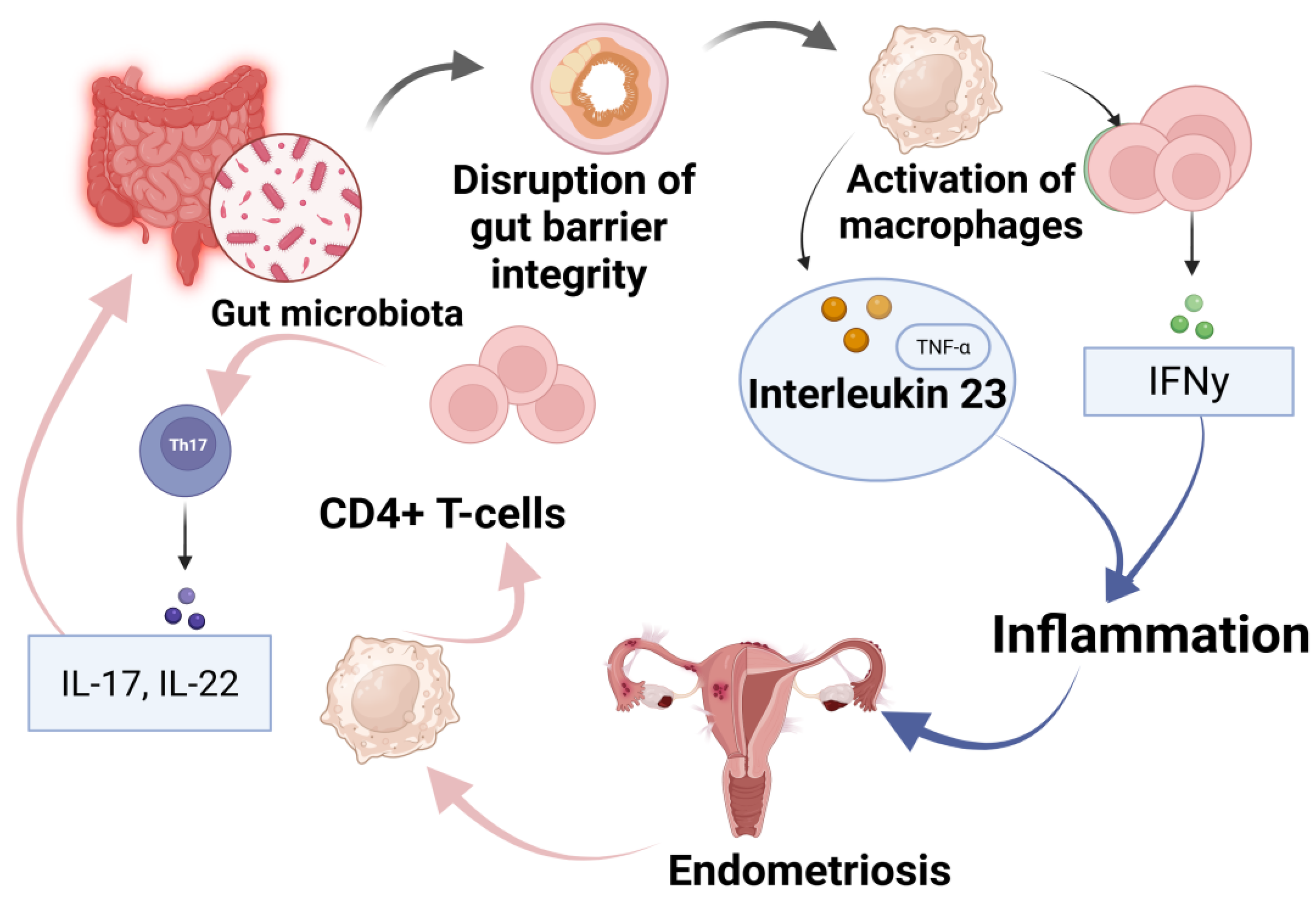
Disfunção imunológica
Células do sistema imune (macrófagos, células NK, linfócitos T) apresentam alteração de função, permitindo sobrevivência e implantação das células endometriais ectópicas.
Inflamação crónica sustentada por citocinas pró-inflamatórias (IL-1β, TNF-α, IL-6, IL-17) e aumento de angiogénese (VEGF).
Microbioma e inflamação
Disbiose intestinal e genital pode alterar o metabolismo dos estrogénios (via estroboloma), aumentar permeabilidade intestinal e favorecer translocação de lipopolissacáridos (LPS), ativando vias inflamatórias como TLR4/NF-κB.
Fatores genéticos e epigenéticos
Alterações genéticas e epigenéticas modulam a resposta hormonal, a imunidade e a expressão de genes ligados à inflamação e à angiogénese, contribuindo para a persistência da doença.
Qual é a ligação da endometriose com a SIBO?
Um estudo de caso-controle envolvendo 1.027 mulheres submetidas ao teste respiratório com lactulose (TRL) constatou que a prevalência de supercrescimento bacteriano no intestino delgado (SBID) e supercrescimento metanogênico intestinal (IMO) foi significativamente maior entre mulheres com endometriose. Especificamente, 91,9% das pacientes com endometriose apresentaram resultado positivo para SBID/IMO, em comparação com 83,1% no grupo controle (P = 0,0223) [1].
Mulheres com endometriose apresentaram maior incidência de trânsito intestinal alterado (85,8% vs. 71%, P = 0,0019), maior prevalência de constipação (67,8% vs. 44,7%, P = 0,0017) e tontura (44,8% vs. 28,7%, P = 0,0245) em comparação com aquelas sem endometriose [1].
O supercrescimento de metano foi prevalente em 63,2% das mulheres com endometriose que testaram positivo para supercrescimento de metano. O SIBO H2 foi associado a um maior risco de desenvolver diarreia (P = 0,0027), enquanto a IMO foi associada a um maior risco de refluxo ácido (P = 0,0132) [1].
Uma revisão da literatura identificou diferenças significativas na microbiota intestinal em nível de gênero em pacientes com endometriose, incluindo aumento de Prevotella, Blautia e Bifidobacterium e diminuição de Paraprevotella, Ruminococcus e Lachnospira (p < 0,05) [2].
A interação entre a endometriose e a composição microbiana intestinal sugere que desequilíbrios hormonais e disfunções imunológicas podem desempenhar um papel na patogênese da endometriose, potencialmente influenciando os sintomas gastrointestinais [2].
O SIBO pode agravar a inflamação da endometriose, resultando em dor e inchaço, além de dificultar a absorção de nutrientes. Prestar atenção à saúde intestinal é fundamental. Aprenda aqui a tratar a SIBO
E após a retirada do útero?
A relação entre histerectomia e supercrescimento bacteriano no intestino delgado (SIBO) tem sido explorada em diversos estudos, embora as evidências não sejam totalmente conclusivas.
Um estudo prospectivo avaliou a prevalência de SIBO em pacientes com histórico de cirurgias abdominais, incluindo histerectomia, gastrectomia e colecistectomia. O estudo envolveu 146 pacientes submetidas a um teste respiratório de glicose com hidrogênio-metano (TBG) para SIBO. Constatou-se que a positividade do TGB foi significativamente maior em pacientes com histórico de cirurgia abdominal em comparação com controles saudáveis (37,6% vs. 13,3%, P < 0,01). Entre os grupos cirúrgicos, o grupo gastrectomia apresentou uma prevalência significativamente maior de SIBO em comparação com o grupo histerectomia [3].
Outro estudo investigou a prevalência de SIBO em pacientes submetidas a cirurgias abdominais, incluindo histerectomia. Revisou 171 pacientes cirúrgicas e constatou que o grupo de gastrectomia apresentou uma preferência significativamente maior pela positividade do teste de função hepática (GBT) em comparação ao grupo de histerectomia. Isso sugere que, embora o SIBO seja comum em pacientes cirúrgicos abdominais, o tipo de cirurgia pode influenciar a prevalência [4].
Uma revisão sistemática destacou a complexa interação entre SIBO e diversas condições médicas, incluindo distúrbios gastrointestinais. Observou-se que o SIBO está associado a distúrbios gastrointestinais funcionais e pode ser influenciado por intervenções cirúrgicas. No entanto, as ligações específicas entre histerectomia e SIBO não foram detalhadas nesta revisão [5].
Aprenda aqui a tratar a SIBO
Precisa de ajuda? Marque sua consulta de nutrição online
Referências
1) P Halfon et al. High prevalence of small intestinal bacterial overgrowth and intestinal methanogen overgrowth in endometriosis patients: A case-control study. International journal of gynaecology and obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics (2025). https://pubmed.ncbi.nlm.nih.gov/39959963/
2) I Iavarone et al. Correlations between Gut Microbial Composition, Pathophysiological and Surgical Aspects in Endometriosis: A Review of the Literature. Medicina (Kaunas, Lithuania) (2023). https://pubmed.ncbi.nlm.nih.gov/36837548/
3) YJ Kim et al. Serum Gastrin Predicts Hydrogen-Producing Small Intestinal Bacterial Overgrowth in Patients With Abdominal Surgery: A Prospective Study. Clinical and translational gastroenterology (2020). https://pubmed.ncbi.nlm.nih.gov/33369565/
4) DB Kim et al. Positive Glucose Breath Tests in Patients with Hysterectomy, Gastrectomy, and Cholecystectomy. Gut and liver (2016). https://pubmed.ncbi.nlm.nih.gov/27965476/
5) N Sroka et al. Show Me What You Have Inside-The Complex Interplay between SIBO and Multiple Medical Conditions-A Systematic Review. Nutrients (2023). https://pubmed.ncbi.nlm.nih.gov/36615748/