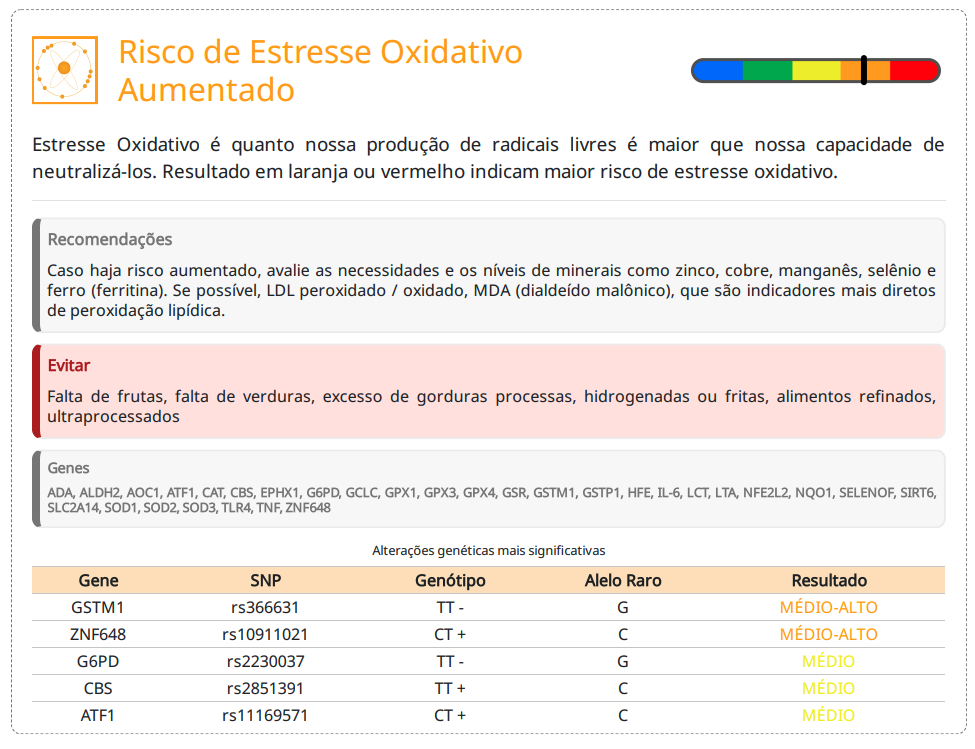
A interpretação dos polimorfismos nesses genes em relação ao risco de estresse oxidativo aumentado deve considerar suas funções na defesa antioxidante, no metabolismo de radicais livres e na resposta inflamatória. São muitos genes importantes e a interpretação ideal é feita de forma agregada, por meio de algorítimos estatísticos:
1. Genes Envolvidos na Neutralização de Espécies Reativas de Oxigênio (ROS)
Esses genes codificam enzimas antioxidantes que neutralizam radicais livres e protegem contra danos oxidativos:
SOD1, SOD2, SOD3 (Superóxido Dismutase 1, 2 e 3)
SOD1 (citoplasmática), SOD2 (mitocondrial) e SOD3 (extracelular) convertem o radical superóxido (O₂⁻) em peróxido de hidrogênio (H₂O₂).
Polimorfismos na SOD2 (Val16Ala, rs4880) estão associados a menor atividade mitocondrial da enzima e maior risco de dano oxidativo.
CAT (Catalase)
Decompõe H₂O₂ em água e oxigênio.
Variantes podem reduzir sua eficiência, aumentando os níveis de peróxido na célula.
GPX1, GPX3, GPX4 (Glutationa Peroxidase 1, 3 e 4)
Reduzem o peróxido de hidrogênio e lipídios oxidados.
Polimorfismos, como rs1050450 (GPX1 Pro198Leu), podem reduzir a atividade antioxidante.
GSR (Glutationa Redutase)
Regenera o glutationa reduzido (GSH), essencial para a defesa antioxidante.
Polimorfismos podem afetar a reciclagem da glutationa e aumentar o estresse oxidativo.
GSTP1, GSTM1 (Glutationa S-Transferases Pi e Mu 1)
Atuam na detoxificação de radicais livres e metabólitos oxidativos.
A deleção de GSTM1 (gene nulo) está associada a maior vulnerabilidade ao estresse oxidativo.
2. Genes Envolvidos no Metabolismo de Substâncias Oxidantes
Esses genes influenciam a degradação de compostos tóxicos e a sensibilidade ao estresse oxidativo:
ALDH2 (Aldeído Desidrogenase 2)
Degrada aldeídos tóxicos, incluindo os gerados pelo estresse oxidativo.
O polimorfismo rs671 (Glu504Lys) reduz sua atividade, aumentando a suscetibilidade ao dano oxidativo.
G6PD (Glicose-6-Fosfato Desidrogenase)
Mantém os níveis de NADPH para regeneração da glutationa.
Deficiências genéticas podem levar a maior vulnerabilidade ao dano oxidativo.
NQO1 (NAD(P)H Quinona Oxidorredutase 1)
Metaboliza quinonas para evitar a formação de radicais livres.
O polimorfismo rs1800566 (C609T) reduz a atividade enzimática, aumentando o estresse oxidativo.
EPHX1 (Epóxido Hidrolase 1)
Atua na detoxificação de epóxidos tóxicos, reduzindo o risco de danos oxidativos.
Polimorfismos podem aumentar ou reduzir sua atividade.
3. Genes Reguladores da Resposta ao Estresse Oxidativo
Esses genes influenciam a ativação de mecanismos antioxidantes e a resposta ao estresse celular:
NFE2L2 (Nrf2 – Nuclear Factor Erythroid 2-Related Factor 2)
Regula a expressão de enzimas antioxidantes.
Polimorfismos podem reduzir sua ativação, diminuindo a defesa antioxidante.
SIRT6 (Sirtuína 6)
Modula a resposta ao estresse oxidativo e a longevidade celular.
Polimorfismos podem influenciar a resistência ao dano oxidativo.
4. Genes Relacionados à Inflamação e Estresse Oxidativo
A inflamação crônica pode aumentar a produção de radicais livres, piorando o estresse oxidativo:
IL-6 (Interleucina-6)
Regula a inflamação e pode aumentar o estresse oxidativo.
O polimorfismo rs1800795 (-174G>C) está associado a níveis elevados de IL-6 e maior inflamação.
TNF (Fator de Necrose Tumoral Alfa)
Polimorfismos, como rs1800629 (-308G>A), aumentam a expressão de TNF-α, amplificando o estresse oxidativo.
TLR4 (Toll-Like Receptor 4)
Modula a resposta inflamatória a patógenos.
Variantes podem aumentar a ativação inflamatória e o dano oxidativo.
5. Outros Genes Relacionados ao Estresse Oxidativo
ADA (Adenosina Desaminase): Relacionada à modulação da resposta imune e inflamatória, podendo afetar indiretamente o estresse oxidativo.
CBS (Cistationina Beta-Sintase): Envolvida no metabolismo da homocisteína, um fator pró-oxidativo.
HFE (Gene da Hemocromatose): Relacionado à homeostase do ferro, impactando a produção de radicais livres via reação de Fenton.
SELENOF (Selenoproteína F): Atua na resposta antioxidante, auxiliando na proteção contra danos oxidativos.
SLC2A14 (Transportador de Glicose 14): Regula o metabolismo energético celular, influenciando indiretamente a produção de ROS.
ZNF648: Possível envolvimento na regulação da expressão gênica em resposta ao estresse oxidativo.
Conclusão
Os polimorfismos nesses genes podem aumentar o risco de estresse oxidativo ao reduzir a capacidade antioxidante, comprometer a detoxificação de metabólitos tóxicos ou amplificar a inflamação. Indivíduos com variantes de SOD2, GPX1, GSTM1, NQO1, NFE2L2, IL-6 e TNF podem apresentar maior suscetibilidade ao dano oxidativo, sendo recomendável adotar estratégias antioxidantes (alimentação rica em antioxidantes, controle da inflamação e redução da exposição a estressores ambientais).
Aprenda mais sobre o tema no curso de GENÔMICA NUTRICIONAL.
Deseja fazer ou interpretar seu exame genético? Marque sua consulta de nutrição de precisão.