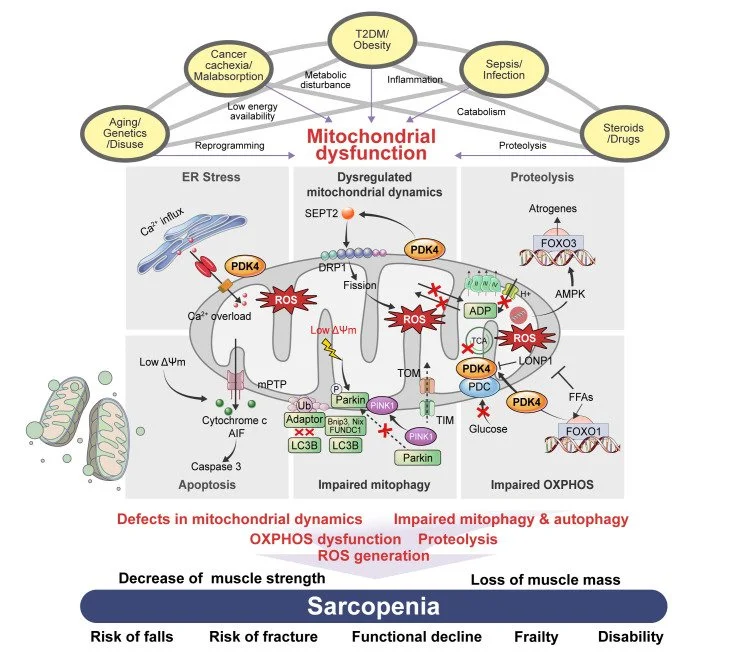
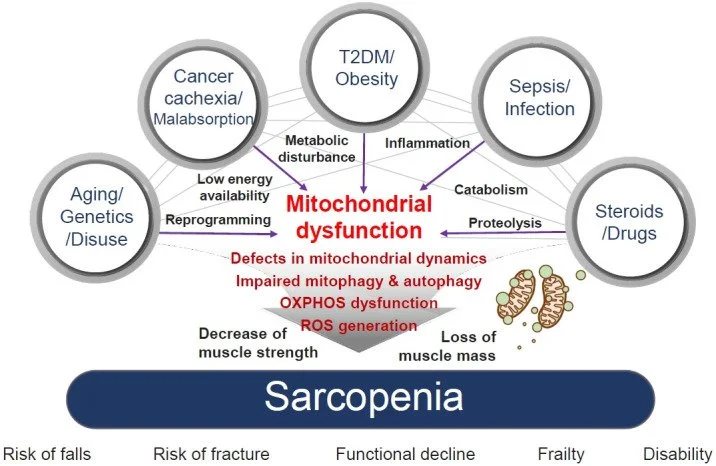
O excesso de cálcio dentro dos neurônios está diretamente relacionado ao processo de morte neuronal e à patogênese de doenças neurodegenerativas, como o Alzheimer. O cálcio é um íon essencial para diversas funções celulares, incluindo a transmissão de sinais nervosos, a contração muscular e a regulação da atividade de várias enzimas. No entanto, quando há um acúmulo excessivo de cálcio nos neurônios, ele pode desencadear uma série de processos tóxicos que levam à morte celular e estão associados a doenças como o Alzheimer.
A liberação excessiva de glutamato ativa os receptores NMDA promovendo a entrada de cálcio nos neurônios e geração de radicais livres, disfunção mitocondrial e morte neuronal (Granzotto, Canzoniero, & Sensi, 2020)
Principais mecanismos pelos quais o excesso de cálcio causa morte neuronal e contribui para o Alzheimer:
1. Desregulação do Cálcio Intracelular
Em condições normais, os neurônios mantêm níveis de cálcio muito baixos no citoplasma, com a maior parte do cálcio armazenado em compartimentos intracelulares, como o retículo endoplasmático e as mitocôndrias. O cálcio é regulado rigorosamente por canais iônicos e bombas de cálcio nas membranas celulares. Quando esses sistemas são desregulados, o cálcio começa a acumular no citoplasma, o que é prejudicial para a célula.
Canais de cálcio: Em doenças como o Alzheimer, há uma disfunção nos canais de cálcio (como o receptor NMDA), permitindo a entrada descontrolada de cálcio no interior da célula.
Danos ao retículo endoplasmático e mitocôndrias: O excesso de cálcio pode prejudicar as organelas celulares responsáveis pela homeostase do cálcio, aumentando ainda mais a carga de cálcio no citoplasma.
2. Ativação de Enzimas Prejudiciais
Quando os níveis de cálcio se elevam de forma excessiva, ele ativa uma série de enzimas que podem causar danos celulares:
Fosfolipases: Estas enzimas destroem as membranas celulares, levando à perda de integridade da célula.
Proteases: Ativadas pelo cálcio, as proteases degradam proteínas essenciais para a função neuronal, como as do citoesqueleto e proteínas de sinalização.
Endonucleases: Enzimas que degradam o DNA, o que pode levar à morte celular programada, ou apoptose.
Esses processos desencadeiam uma cascata de eventos que comprometem a integridade estrutural e funcional do neurônio.
3. Estresse Oxidativo
O excesso de cálcio também pode gerar estresse oxidativo. Quando há um aumento na carga de cálcio, as mitocôndrias tentam se adaptar, mas podem começar a produzir quantidades excessivas de espécies reativas de oxigênio (EROs), como o superóxido e o peróxido de hidrogênio. Essas moléculas são altamente reativas e danificam proteínas, lipídios e o DNA celular.
O estresse oxidativo é um dos principais mecanismos de dano celular em doenças neurodegenerativas, incluindo o Alzheimer.
4. Disfunção Mitocondrial
As mitocôndrias são responsáveis pela produção de ATP (energia celular) e também desempenham um papel importante na homeostase do cálcio. Quando os níveis de cálcio se elevam excessivamente no citoplasma, as mitocôndrias podem se sobrecarregar. Isso prejudica sua capacidade de gerar energia e pode levar à liberação de proteínas pró-apoptóticas, como o citocromo C, que desencadeiam a morte celular programada (apoptose).
A disfunção mitocondrial também contribui para a redução da capacidade da célula de manter o equilíbrio de cálcio, exacerbando ainda mais a toxicidade do cálcio excessivo.
5. Alterações na Sinalização Celular
O cálcio tem um papel fundamental na sinalização celular, influenciando processos como a secreção de neurotransmissores e a plasticidade sináptica. No entanto, o acúmulo excessivo de cálcio interfere nessa sinalização:
Disfunção na neurotransmissão: O excesso de cálcio pode comprometer a liberação de neurotransmissores, prejudicando a comunicação entre os neurônios.
Alterações nas vias de sinalização: No Alzheimer, há evidências de que a acumulação de cálcio pode afetar negativamente a sinalização mediada por proteínas como a proteína tau, que está envolvida na formação de emaranhados neurofibrilares, um dos marcos patológicos dessa doença.
6. Acúmulo de Proteínas Tóxicas
No Alzheimer, o excesso de cálcio está relacionado ao acúmulo de proteínas anormais, como a proteína tau (que forma os emaranhados neurofibrilares) e a proteína beta-amiloide (que forma as placas amiloides). O aumento do cálcio intracelular pode:
Aumentar a fosforilação de proteínas, como a tau, que resulta na formação de emaranhados.
Promover a formação de agregados de beta-amiloide, uma característica distintiva do Alzheimer, que é tóxica para os neurônios.
Esses depósitos de proteínas danificam as células nervosas, interferem na função neuronal e contribuem para a progressão da doença.
Neurônios glutamatérgicos e acetilcolinérgicos no Alzheimer
No contexto da Doença de Alzheimer (DA), os neurônios glutamatérgicos e acetilcolinérgicos desempenham papéis fundamentais na progressão da doença, afetando diversos processos neurobiológicos. A seguir, explico o papel de cada tipo de neurônio e como eles impactam a fisiologia cerebral em Alzheimer:
1. Neurônios Glutamatérgicos no Alzheimer
Os neurônios glutamatérgicos são os principais mediadores da neurotransmissão excitatória no cérebro. O glutamato é o principal neurotransmissor excitador, e ele desempenha um papel crucial na plasticidade sináptica, no aprendizado e na memória.
Impacto dos Neurônios Glutamatérgicos na Doença de Alzheimer:
Excitotoxicidade: A característica central da DA é o excesso de glutamato e a ativação excessiva dos receptores NMDA (N-metil-D-aspartato), que pode resultar em excitotoxicidade. Isso ocorre quando níveis elevados de glutamato ativam os receptores NMDA de forma excessiva, o que leva ao influxo excessivo de cálcio nos neurônios. Esse excesso de cálcio no interior das células pode danificar as mitocôndrias, induzir a produção de espécies reativas de oxigênio (EROs) e desencadear a morte neuronal.
Neurodegeneração: O excesso de glutamato contribui para a morte neuronal e a perda de sinapses, aspectos característicos do Alzheimer. A excitotoxicidade pode danificar particularmente áreas do cérebro envolvidas na memória e no aprendizado, como o hipocampo e o córtex cerebral.
Dano à plasticidade sináptica: O glutamato é essencial para a plasticidade sináptica, que é a base neurobiológica do aprendizado e da memória. Em Alzheimer, o excesso de glutamato pode prejudicar essa plasticidade, exacerbando a deterioração cognitiva.
Medicamentos como os antagonistas dos receptores NMDA, como a memantina, são usados para reduzir os efeitos tóxicos do glutamato, ajudando a controlar a excitotoxicidade e a proteger os neurônios.
2. Neurônios Acetilcolinérgicos no Alzheimer
Os neurônios acetilcolinérgicos utilizam a acetilcolina como neurotransmissor e são essenciais para o processamento da memória, atenção, aprendizado e controle motor.
Impacto dos Neurônios Acetilcolinérgicos na Doença de Alzheimer:
Déficit de Acetilcolina: Em pacientes com Alzheimer, há uma diminuição significativa da atividade acetilcolinérgica, devido à degeneração de neurônios colinérgicos (neurônios que liberam acetilcolina). As regiões afetadas incluem o núcleo basálio de Meynert, uma área chave para a produção de acetilcolina, que está envolvida na atenção e memória.
Declínio Cognitivo: O déficit de acetilcolina resulta em comprometimento da função cognitiva, particularmente na memória de curto prazo e na formação de novas memórias. A perda da função colinérgica é uma das primeiras anormalidades no Alzheimer, contribuindo para o déficit de aprendizado e a dificuldade de recordação de informações.
Desregulação da Comunicação Cerebral: A acetilcolina também é importante para a modulação de outras funções cognitivas, como a atenção e o controle de respostas emocionais. A falta de acetilcolina compromete essas funções e agrava os sintomas cognitivos e comportamentais da DA.
O tratamento farmacológico para combater a deficiência acetilcolinérgica no Alzheimer geralmente envolve inibidores da acetilcolinesterase, como a donepezila, rivastigmina e galantamina, que aumentam os níveis de acetilcolina no cérebro ao inibir a enzima que a degrada, aliviando temporariamente os sintomas cognitivos da doença.
3. Interação entre Neurônios Glutamatérgicos e Acetilcolinérgicos no Alzheimer
Embora os neurônios glutamatérgicos e acetilcolinérgicos desempenhem funções distintas no cérebro, sua interação e o equilíbrio entre a excitação e a inibição são cruciais para a função cognitiva saudável. No Alzheimer:
O déficit acetilcolinérgico contribui para a perda de controle sobre os processos cognitivos e memoriais, enquanto a excitação excessiva do glutamato pode exacerbar a neurodegeneração.
A desregulação do equilíbrio entre excitação (glutamato) e inibição (acetilcolina) é um fator chave na deterioração cognitiva observada no Alzheimer, criando um ambiente que favorece a degeneração neuronal e a perda de sinapses.
Medicamentos sozinhos não são eficientes
Para ajudar a reduzir esse excesso de cálcio e melhorar a saúde neuronal, diversas estratégias nutricionais podem ser implementadas, algumas das quais são detalhadas a seguir:
1. Dieta Anti-inflamatória
Uma dieta anti-inflamatória pode ajudar a reduzir a inflamação neural e a excitotoxicidade. Alimentos ricos em antioxidantes, como frutas e vegetais (especialmente aqueles com alto teor de flavonoides, como berries, maçãs e vegetais de folhas verdes), podem ajudar a proteger os neurônios contra danos causados pelo excesso de cálcio.
Alimentos recomendados:
Frutas como morangos, mirtilos, maçãs e laranjas.
Vegetais verdes, como espinafre e couve.
Frutos secos e sementes, como nozes e amêndoas.
Peixes ricos em ácidos graxos ômega-3, como salmão e sardinha.
2. Suplementação de Magnésio
O magnésio é um antagonista natural do cálcio e pode ajudar a regular a entrada de cálcio nas células nervosas. Ele interfere com os canais de cálcio e pode ajudar a reduzir a excitotoxicidade, protegendo os neurônios glutamatérgicos.
Fontes alimentares de magnésio:
Nozes, amêndoas e castanhas.
Vegetais de folhas verdes escuras, como espinafre e acelga.
Grãos integrais, como aveia e quinoa.
Leguminosas, como feijão e lentilhas.
3. Redução de Glutamato Livre
O glutamato, o principal neurotransmissor excitatório no cérebro, está envolvido na regulação do cálcio dentro das células nervosas. Em excesso, pode promover a entrada excessiva de cálcio nas células e causar excitotoxicidade. Controlar a ingestão de glutamato através de uma dieta pode ser útil. Alimentos processados e aditivos alimentares como o glutamato monossódico (MSG) podem aumentar o risco de excitotoxicidade.
Dicas:
Evitar alimentos altamente processados, que podem conter glutamato monossódico.
Optar por alimentos frescos e naturais, que tendem a ter menos aditivos.
4. Ácidos Graxos Ômega-3
Estudos sugerem que os ácidos graxos ômega-3 têm um efeito neuroprotetor e podem ajudar a reduzir a inflamação cerebral e a excitotoxicidade. O ômega-3 pode melhorar a fluidez da membrana neuronal e regular a entrada de cálcio nas células.
Fontes de ômega-3:
Peixes oleosos, como salmão, sardinha e atum.
Sementes de linhaça e chia.
Nozes e óleos vegetais, como óleo de canola e de linhaça.
5. Dieta Rica em Vitaminas e Minerais
Além do magnésio, outras vitaminas e minerais, como as vitaminas do complexo B (especialmente B6, B9 e B12) e o zinco, desempenham papéis fundamentais na função neuronal e podem ajudar a regular a homeostase do cálcio.
Fontes recomendadas:
Vitaminas B: Carne magra, peixes, ovos, leguminosas, vegetais de folhas verdes.
Zinco: Carnes, frutos do mar, nozes, sementes e legumes.
6. Restrição de Cálcio em Excesso
Embora o cálcio seja essencial para a saúde óssea e muscular, o excesso de cálcio na dieta pode contribuir para a sobrecarga de cálcio neuronal, especialmente em indivíduos suscetíveis. Manter uma ingestão equilibrada de cálcio, sem excessos, pode ser benéfico.
Dicas:
Evitar a ingestão excessiva de suplementos de cálcio, a menos que indicado por um médico.
Consumir fontes alimentares de cálcio de forma moderada, como leite e derivados, tofu, e vegetais como brócolis e couve.
7. Polifenóis e Compostos Antioxidantes
O consumo de compostos antioxidantes pode reduzir o estresse oxidativo e a inflamação, fatores que contribuem para a excitotoxicidade e a entrada excessiva de cálcio nos neurônios.
Alimentos ricos em antioxidantes:
Chá verde, especialmente com catequinas.
Cúrcuma e pimenta-preta, que possuem compostos anti-inflamatórios potentes (curcumina).
Chocolate amargo (rico em flavonoides).
8. Práticas Gerais de Saúde Neural
Além de intervenções dietéticas, outras estratégias podem complementar a redução do excesso de cálcio nos neurônios:
Exercício físico: O exercício regular tem efeito neuroprotetor, promovendo a saúde cerebral e ajudando a regular o metabolismo de cálcio no sistema nervoso.
Sono adequado: O descanso adequado é fundamental para a saúde cerebral e para a regulação do cálcio e de outros íons no cérebro.
Em resumo, uma combinação de uma dieta balanceada com ênfase em antioxidantes, ácidos graxos essenciais, minerais como magnésio e zinco, e a moderação do glutamato e cálcio pode ser útil para reduzir o excesso de cálcio nos neurônios glutamatérgicos. Se houver suspeita de condições neurológicas, é importante buscar orientação com um neurologista. Para individualização da dieta e suplementação marque aqui sua consulta de nutrição online