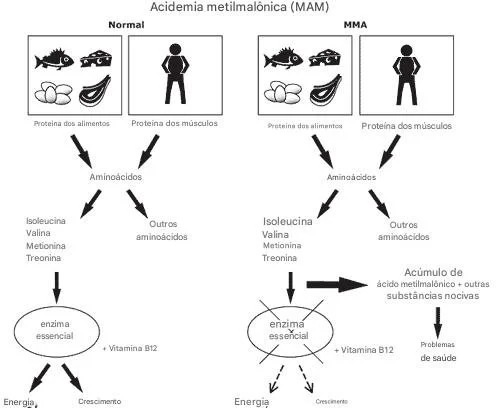
A acidemia metilmalônica (AMM ou MMA ou MAM) ou acidúria metilmalônica é uma doença metabólica rara que afeta a capacidade do corpo de processar certos aminoácidos essenciais. Embora possa ser grave, o diagnóstico precoce e o tratamento adequado podem melhorar significativamente o prognóstico.
O que é a acidemia metilmalônica?
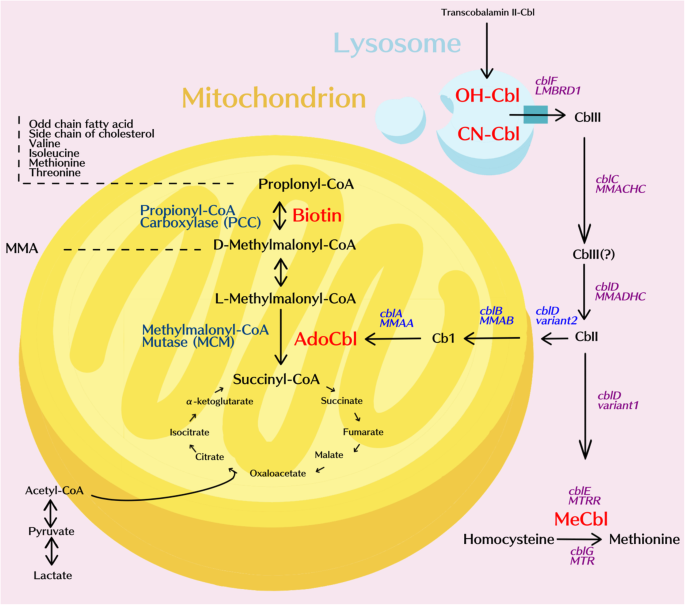
A AMM é causada por defeitos na enzima metilmalonil-CoA mutase (MMUT) ou em genes relacionados ao metabolismo da vitamina B12 (como MMAA, MMAB e MMACHC). Esses defeitos levam ao acúmulo de ácido metilmalônico, causando acidose metabólica, crises metabólicas e, em casos graves, comprometimento de órgãos vitais.
A doença pode se apresentar de formas variadas, dependendo do tipo genético e da gravidade da mutação.
Genética e polimorfismos de risco
A AMM é geneticamente heterogênea. Os principais subtipos são:
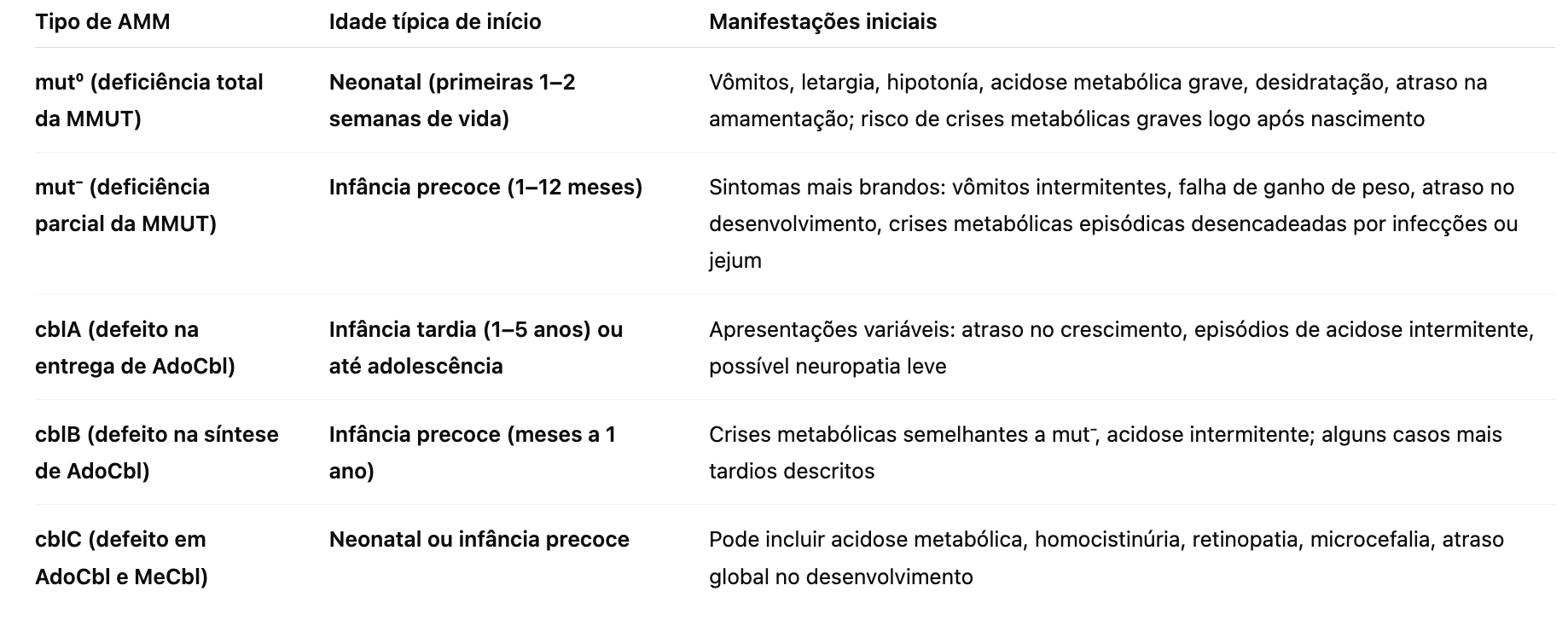
mut⁰ (deficiência total da MMUT): forma grave, com sintomas neonatais intensos. Polimorfismos comuns: c.19C>T, c.52C>T, c.91C>T, c.278G>A, c.322C>T.
mut⁻ (deficiência parcial da MMUT): sintomas podem aparecer na infância precoce; polimorfismos: c.299A>G, c.566A>T, c.828G>C, c.947A>G, c.2080C>T.
cblA (defeito na entrega de adenosilcobalamina): geralmente leve, bom prognóstico; variantes: c.394C>T, c.567dupT.
cblB (defeito na síntese de adenosilcobalamina): variabilidade clínica; variantes: c.96T>C, c.174_175delAG.
cblC (defeito na síntese de adenosilcobalamina e metilcobalamina): formas neonatais graves; variantes: c.394C>T, c.567dupT, c.609G>A.
Os polimorfismos identificam o risco, ajudam no diagnóstico precoce e orientam a expectativa de resposta ao tratamento.
Idade típica de suspeita clínica
Neonatal (primeiras semanas de vida): formas mut⁰ ou cblC graves → crises metabólicas intensas, vômitos, letargia, acidose grave.
Infância precoce (1–12 meses): mut⁻ e cblB → sintomas intermitentes, atraso no crescimento e crises desencadeadas por infecção ou jejum.
Infância tardia / adolescência: cblA e formas leves de mut⁻ → sintomas mais brandos, crises menos frequentes.
O teste do pezinho expandido é essencial para diagnóstico precoce, permitindo intervenção antes do primeiro episódio grave.
Tratamento
O tratamento da AMM depende do subtipo e da gravidade:
Crise aguda
Suspender temporariamente proteínas e fornecer calorias por via IV (glicose e lipídios) para evitar catabolismo.
L-carnitina IV, glicina (250mg/kg/dia) e B2 para eliminar ácidos orgânicos acumulados.
Correção de acidose metabólica e hiperamonemia (diálise em casos graves).
Hidroxocobalamina IV nos subtipos responsivos (cblA, cblB, alguns mut⁻).
Antibióticos (como metronidazol) para reduzir produção intestinal de propionato.
Tratamento crônico
Dieta hipoproteica controlada: limitar aminoácidos precursores do propionil-CoA.
Suplementos: L-carnitina, vitamina B12 (hidroxocobalamina) nos subtipos responsivos.
Acompanhamento metabólico regular: monitoramento de ácido metilmalônico, função renal, crescimento e desenvolvimento.
Transplante hepático ou hepatorrenal em casos graves, para reduzir crises metabólicas.
Observação importante: a adenosilcobalamina é o cofator ativo da MMUT, mas não é administrada diretamente via intravenosa; usa-se hidroxocobalamina, que é convertida em AdoCbl dentro das células.
Prognóstico
O prognóstico depende de vários fatores:
mut⁰: formas graves, mortalidade alta na infância sem manejo intensivo.
mut⁻: variabilidade; boa sobrevida com tratamento adequado.
cblA: geralmente bom; expectativa de vida próxima do normal.
cblB / cblC: dependente da resposta à vitamina B12 e controle metabólico; risco de complicações neurológicas e renais.
Repercussões cognitivas
As repercussões cognitivas são comuns, especialmente em:
formas graves (mut⁰, cblC neonatal)
crises metabólicas repetidas ou não tratadas
Principais efeitos:
Atraso global do desenvolvimento
Déficits de memória, atenção e funções executivas
Problemas de coordenação motora
Em casos graves, atraso mental profundo
Fatores que melhoram o prognóstico cognitivo: diagnóstico precoce, controle metabólico adequado e tratamento com hidroxocobalamina nos subtipos responsivos.
E se ácido metilmalônico aumentar em outras fases da vida?
O ácido metilmalônico pode aumentar em qualquer pessoa, mesmo que não tenham mutações de MMUT. Isto pode acontecer no caso de deficiência de B12, causada por abuso e álcool, dieta vegana sem suplementação, disbiose, medicações inibidoras da bomba de prótons, envelhecimento e hipocloridria. As consequências da deficiência de B12 nestes casos inclui: elevação de homocisteína, fadiga, depressão, hiperreflexia, neuropatia periférica, infecções do trato respiratório superior, desordens gastrointestinais, anemia (mascarada muitas vezes pelo ácido fólico, vitamina B9), doença isquêmica do coração, acidente vascular cerebral e trombose venosa profunda. O tratamento neste caso é a administração de adenosilcobalamina, retirada do álcool e tratamento da disbiose, conforme o caso. Monitoramos o sucesso da terapia com exames metabolômicos.