Xenobiótico é o nome dado às substâncias químicas que são estranhas a um organismo ou sistema — ou seja, não são produzidas naturalmente (ou não se esperaria que estivessem presentes) no organismo ou no ambiente biológico em que se encontram. Na ciência ambiental e toxicológica, o termo é usado para referir poluentes, fármacos, aditivos industriais, etc., muitas vezes sintetizados pelo homem e que podem ter impacto ecológico ou em saúde.
A palavra xenobiótico vem do grego e é formada por três partes principais:
xénos (ξένος) → “estrangeiro”, “estranho”, “de fora”;
bíos (βίος) → “vida”;
-ico → sufixo latino e grego usado para formar adjetivos, com o sentido de “relativo a”.
Assim, xenobiótico = “relativo a algo estranho à vida” ou, mais precisamente, “substância estranha a um sistema biológico”.
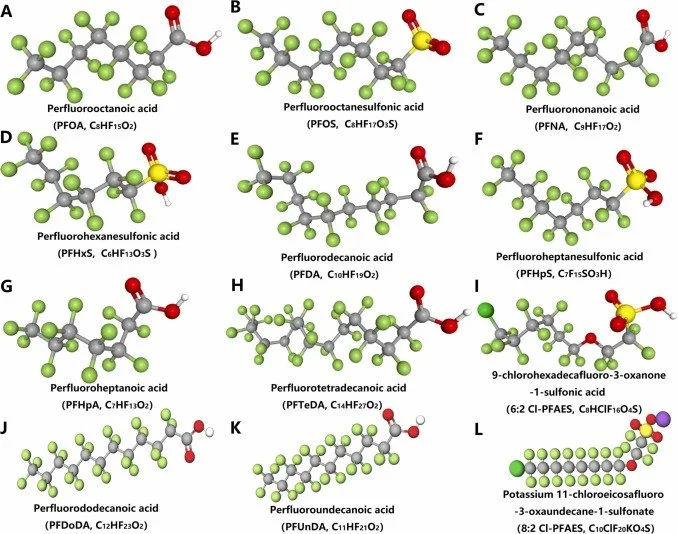
As substâncias perfluoroalquiladas e polifluoroalquiladas (PFAS) são um grupo de substâncias químicas sintéticas persistentes, amplamente utilizadas em revestimentos industriais, embalagens, repelentes e que se acumulam no ambiente e nos organismos humanos. São resistentes à degradação natural e bioacumulam-se - características típicas de xenobióticos.
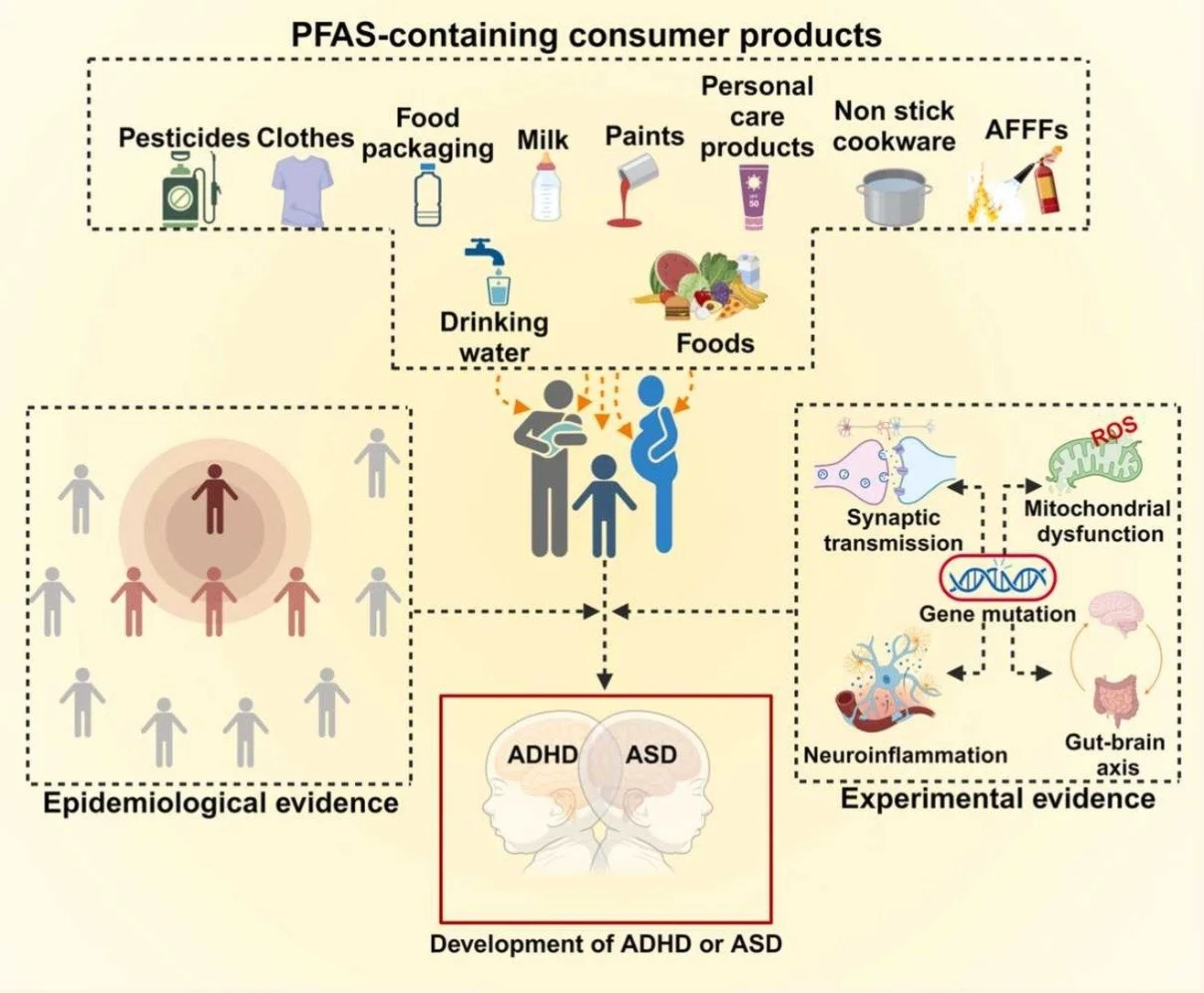
Há crescente interesse em entender se a exposição a PFAS — especialmente em fases precoces da vida — pode influenciar o desenvolvimento neuropsiquiátrico, nomeadamente TDAH e ASD.
Evidência epidemiológica
Alguns estudos indicam que a exposição pré‑natal ou na infância a certos PFAS pode estar associada a maior risco ou maior gravidade de TDAH ou ASD. Por exemplo: exposição pré‑natal a Perfluorooctanoic acid (PFOA) associou‑se a maior probabilidade de ASD e de TDAH em crianças (Skogheim et al., 2021)
No entanto, os resultados não são uniformes: em alguns estudos não se encontrou associação significativa ou até se observaram associações inversas (ou protecção aparente) para alguns PFAS e determinados outcomes (Shin et al., 2020).
A literatura aponta para efeitos potencialmente modestos, com grandes variações entre estudos (diferenças nas substâncias PFAS investigadas, janelas temporais de exposição, metodologias, populações).
Um estudo com gestantes mediu PFAS maternos e examinou traços de autismo em crianças, encontrando para algumas substâncias uma associação positiva, mas para o conjunto da mistura não se verificou associação consistente.
Evidência experimental / mecanismos plausíveis
Estudos experimentais sugerem que os PFAS podem perturbar funções neurodesenvolvimentais através de múltiplos mecanismos: interferência hormonal (por serem disruptores endócrinos), indução de estresse oxidativo, inflamação crônica, alterações da microbiota intestinal, disrupção de neurotransmissores. Estas vias fornecem plausibilidade biológica para uma ligação entre PFAS e alterações de neurodesenvolvimento que se manifestam como TDAH ou TEA.
Contudo, há lacunas: por exemplo, falta de biomarcadores consistentes, heterogeneidade nas exposições (tipos de PFAS, doses, janelas críticas), e confusão potencial com fatores genéticos ou outros tóxicos ambientais.
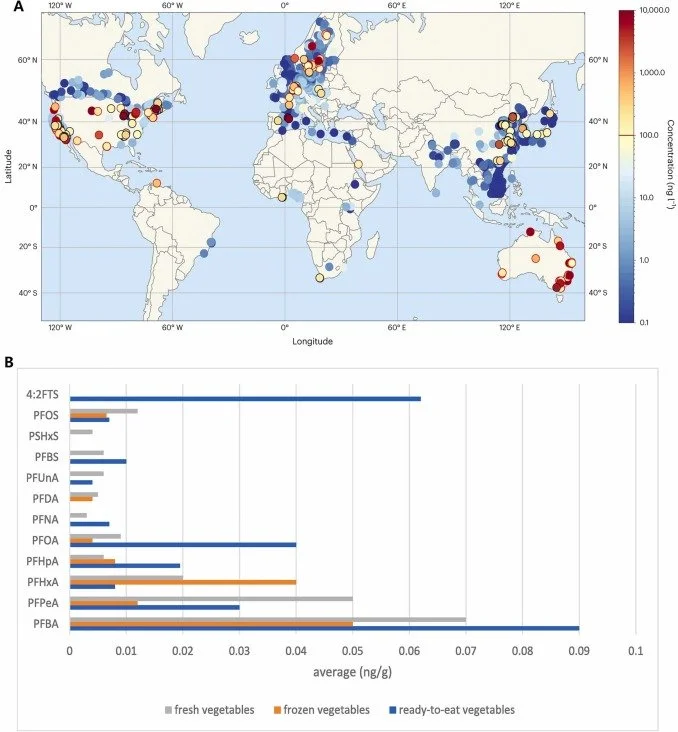
Níveis de PFAs na água e amostras de vegetais (Wu et al., 2025)
Considerações & implicações para o blog
Apesar de a ligação entre PFAS e TDAH/ASD não estar firmemente estabelecida, sabemos que existem períodos (pré‑natal, infância) onde o cérebro é mais vulnerável. Assim, reduzir exposição a PFAS (quando possível) faz sentido como medida de precaução. Se houver risco elevado de exposição (ex: proximidade a fontes conhecidas, consumo de água/água contaminada, produtos com PFAS) vale considerar mitigação.
Concentração de PFAs nos alimentos (Wu et al., 2025)
No plano científico: há necessidade de mais estudos robustos, com amostras maiores, melhor caracterização de exposições e controle de variáveis de confusão para clarificar se e como os PFAS contribuem para o risco de TDAH ou TEA. Na saúde pública, é importante monitorizar substâncias persistentes e considerar suas possíveis implicações neurodesenvolvimentais.