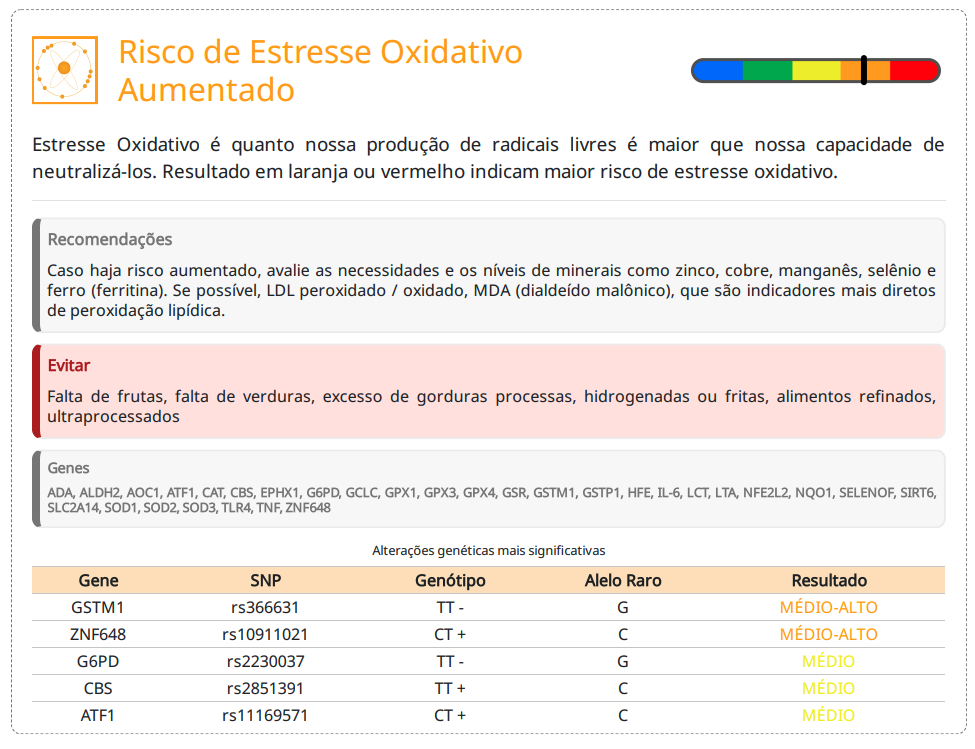
O ácido fumárico (ou fumarato) é um intermediário do ciclo do ácido tricarboxílico (TCA) (Ciclo de Krebs), essencial para a produção de energia nas mitocôndrias. Ele desempenha um papel na respiração celular, metabolismo de aminoácidos e resposta antioxidante. Níveis baixos de ácido fumárico podem indicar disfunção mitocondrial, metabolismo energético comprometido ou alteração na utilização de aminoácidos.
Possíveis Causas do Ácido Fumárico Baixo
Disfunção Mitocondrial
O funcionamento ineficiente do ciclo de Krebs pode reduzir os níveis de fumarato.
Pode ser causado por doenças mitocondriais genéticas ou estresse oxidativo que danifica enzimas mitocondriais.
Deficiências Nutricionais
Níveis baixos de precursores/cofatores das enzimas do ciclo de Krebs, como:
Vitaminas do complexo B (B2, B3, B5) – essenciais para a função enzimática.
Magnésio – importante para a produção de ATP.
Ferro – necessário para certas enzimas mitocondriais.
Disponibilidade Reduzida de Proteínas ou Aminoácidos
O fumarato pode ser produzido a partir do aspartato, tirosina e fenilalanina.
Deficiências desses aminoácidos (por dieta inadequada ou má absorção digestiva) podem contribuir para níveis baixos de fumarato.
Síndrome da Fadiga Crônica e Distúrbios Metabólicos
Síndrome da fadiga crônica (SFC/EM) ou fibromialgia podem apresentar desequilíbrios no ciclo de Krebs.
Hipotireoidismo ou metabolismo lento podem prejudicar a produção de fumarato.
Exposição a Metais Pesados ou Toxinas
Metais pesados (chumbo, mercúrio) e toxinas ambientais podem afetar as enzimas mitocondriais do ciclo TCA.
Deficiência de Fumarase (Doença Genética Rara)
Um defeito enzimático raro que impede a produção adequada de fumarato.
Associado a problemas neurológicos e atrasos no desenvolvimento.
Formas de Modular e Aumentar os Níveis de Ácido Fumárico
Apoiar a Função Mitocondrial
Aumentar a ingestão de cofatores mitocondriais:
Coenzima Q10 (CoQ10)
Ácido alfa-lipóico
L-carnitina
Magnésio
Garantir uma Ingestão Adequada de Aminoácidos
Consumir proteínas ou suplementos de aminoácidos contendo:
Aspartato
Tirosina
Fenilalanina
Otimizar os Níveis de Vitaminas do Complexo B
Vitamina B2 (Riboflavina), B3 (Niacina), B5 (Ácido Pantotênico) – todas essenciais para o metabolismo energético.
Melhorar a Eficiência do Ciclo de Krebs
Ácido málico (presente em maçãs e suplementos) pode ajudar a aumentar a produção de fumarato.
N-acetilcisteína (NAC) reduz o estresse oxidativo que pode afetar as mitocôndrias.
Reduzir o Estresse Oxidativo e Desintoxicar
Apoiar os níveis de glutationa (NAC, selênio, cardo-mariano).
Evitar exposição a metais pesados (testar e usar quelantes, se necessário).
Exercício Físico e Terapia com Luz Vermelha
Exercício aeróbico moderado melhora a eficiência mitocondrial e pode estimular a produção de fumarato.
Terapia com luz vermelha/infravermelha (LLLT) melhora a função mitocondrial.