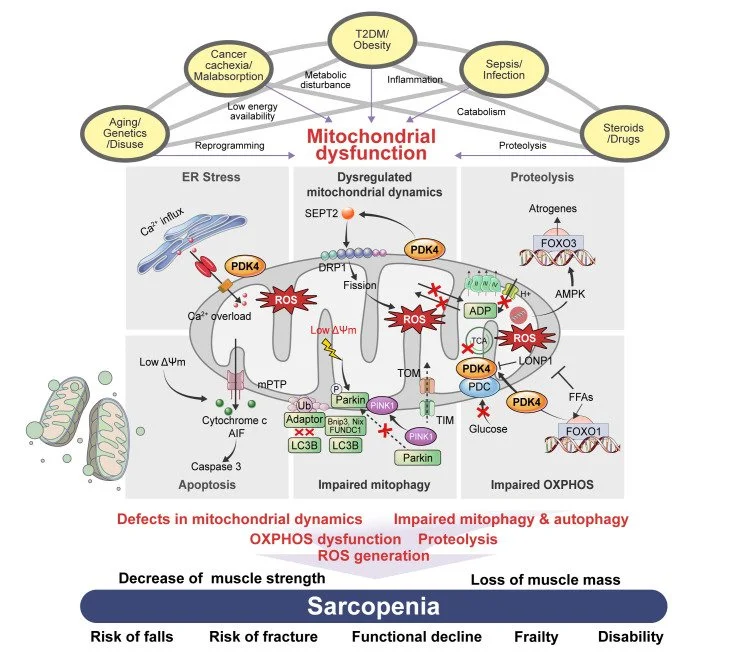
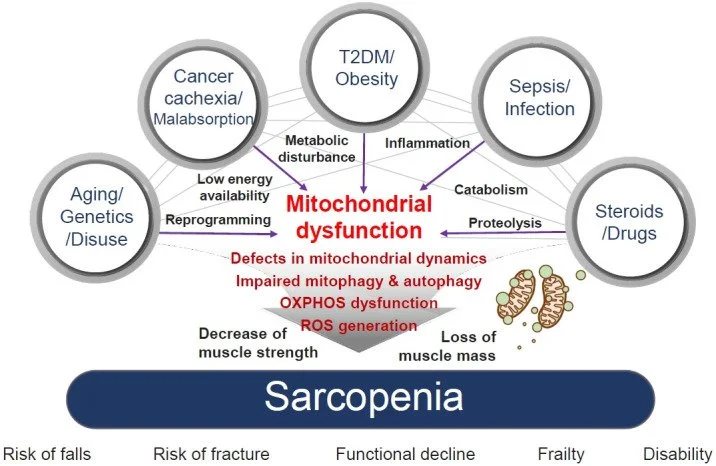
A sarcopenia, caracterizada pela perda progressiva de massa e força muscular com a idade, é uma condição que afeta a qualidade de vida, principalmente em idosos. A resistência à insulina (RI), um fator de risco para diabetes tipo 2, tem sido cada vez mais associada à sarcopenia. Estudos recentes sugerem que há uma relação causal entre essas duas condições, onde a resistência à insulina pode agravar a perda muscular. Este post explora essa conexão e as implicações para a saúde muscular e metabólica.
O que é Resistência à Insulina?
A resistência à insulina ocorre quando as células do corpo não respondem de maneira eficaz à insulina, um hormônio responsável por regular os níveis de glicose no sangue. Como resultado, o pâncreas aumenta a produção de insulina para compensar a resposta insuficiente, o que pode levar a níveis elevados de glicose e insulina no sangue ao longo do tempo.
A Sarcopenia e Seus Efeitos
A sarcopenia é definida pela perda de massa muscular e função, o que prejudica a mobilidade, a força e a capacidade de realizar atividades diárias. Ela está frequentemente associada ao envelhecimento, mas fatores como desnutrição, sedentarismo, obesidade e doenças crônicas (como resistência à insulina) podem acelerar seu desenvolvimento.
A conexão entre resistência à insulina e sarcopenia ocorre de várias maneiras, afetando diretamente o metabolismo muscular e a regulação do crescimento muscular. Alguns dos mecanismos principais incluem:
Disfunção no Metabolismo da Glicose e Aminoácidos: A resistência à insulina prejudica a utilização da glicose e pode reduzir a disponibilidade de aminoácidos essenciais para a síntese de proteínas musculares. Isso leva à diminuição da capacidade do músculo de reparar e crescer, facilitando a perda muscular.
Aumento da Inflamação Crônica: A resistência à insulina está associada a um estado inflamatório crônico de baixo grau. A inflamação pode inibir a sinalização de insulina no músculo e reduzir a capacidade de regeneração e crescimento muscular, contribuindo para a perda de massa muscular.
Interferência na Atividade da Proteína Anabólica (mTOR): A resistência à insulina pode interferir na via mTOR, uma via crucial para o crescimento muscular. Essa via é responsável pela síntese de proteínas e pelo anabolismo muscular, e sua disfunção devido à resistência à insulina pode acelerar a perda muscular.
Alterações no Metabolismo Lipídico: A resistência à insulina também pode aumentar o acúmulo de gordura no músculo, o que pode resultar em uma infiltração de gordura nas fibras musculares, prejudicando sua função e contribuindo para a sarcopenia.
Prevenção e tratamento da Sarcopenia
Entender a relação causal entre resistência à insulina e sarcopenia abre novas abordagens para o tratamento de ambas as condições:
Controle da glicemia e sensibilidade à insulina: Melhorar a resposta à insulina por meio de intervenções como a dieta, exercícios físicos e, em alguns casos, medicação, pode ajudar a prevenir ou tratar a sarcopenia.
Exercícios de resistência: O treinamento de força e a atividade física regular são fundamentais para melhorar a sensibilidade à insulina e promover a síntese de proteínas musculares, combatendo a sarcopenia.
Suplementação e alimentação adequada: Uma dieta rica em proteínas, especialmente aminoácidos essenciais como a leucina, pode ajudar na recuperação e manutenção da massa muscular, especialmente em indivíduos com resistência à insulina.
Precisa de ajuda? Marque aqui sua consulta de nutrição